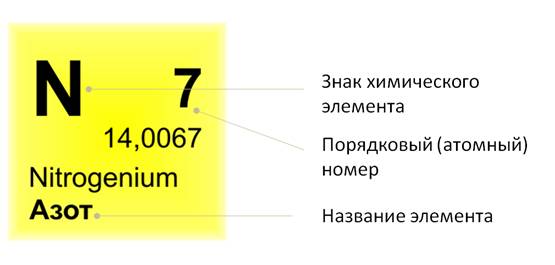
Если посмотреть в периодическую таблицу Д. И. Менделеева, то можно заметить, что все элементы в ней расположены в клетках. В таких клетках изображён знак химического элемента, его название. Вверху клетки указан порядковый, или атомный, номер. Над символом элемента – его название.
Например, рассмотрим клетку, где расположен элемент сера. Здесь указано название элемента, его символ. Вверху стоит число 16. А что же обозначает нижнее число 32,064?
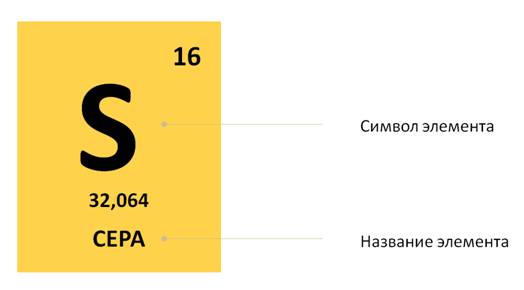
Это число называется относительной атомной массой. Как известно, важным свойством атомов является их масса, она выражается в граммах, киллограммах, миллиграммах.
Ещё в девятнадцатом веке, когда все учёные наконец-то приняли атомно- молекулярное учение (то есть было доказано, что вещества состоят из молекул и атомов), были рассчитаны атомные массы химических элементов.
Эти массы оказались очень маленькими. Это и понятно, ведь атомы настолько малы, что их не увидишь даже в самые мощные микроскопы.
Для удобства массы атомов химических элементов сравнивают с массой атома самого лёгкого химического элемента – водорода. Масса атома водорода равна 1. Поэтому можно сказать, что масса атома серы в 32 раза больше массы атома водорода.
То есть относительная атомная масса – это величина, которая показывает, во сколько раз масса атома данного химического элемента больше массы атома водорода.
Относительную атомную массу обозначают символом Ar, где буква r – это первая буква английского слова relative, что означает «относительный».
Все значения относительных атомных масс округляют до целого значения по всем правилам округления. Единственным исключением является элемент хлор, у которого относительная атомная масса равна 35,5. Так, относительная атомная масса кислорода – 16, азота – 14, углерода – 12, железа – 56, меди – 64, фтора – 19, алюминия – 27, цинка – 65, фосфора – 31, брома – 80.

Как вы могли заметить, относительная атомная масса является безразмерной величиной.
Как и атомы, молекулы обладают массой. Для того, чтобы найти их массу, нужно сложить массы всех атомов, которые входят в состав молекулы.
То есть относительная молекулярная масса – это сумма относительных атомных масс атомов, входящих в состав молекул.
Например, определим относительную молекулярную массу воды – Н2О. Для этого относительную атомную массу водорода умножаем на 2, так как в молекуле 2 атома водорода, на что нам указывает индекс. Затем складываем относительную атомную массу водорода с относительной атомной массой кислорода. Подставляем значения и получаем результат – 18.
Mr (H2O) = Ar (H) · 2 + Ar (O) = 1 · 2 + 16 = 18
Понятие «относительная молекулярная масса» справедливо только для веществ молекулярного строения, если же вещество состоит из атомов или ионов, тогда вместо относительной молекулярной массы говорят об относительной формульной массе.
Определим относительную молекулярную массу углекислого газа – СО2. Для этого относительную атомную массу углерода складываем с относительной атомной массой кислорода, умноженной на два, так как в молекуле 2 атома кислорода. Подставляем значения относительных атомных масс: 12 складываем с 32 и получаем 44.
Mr (CO2) = Ar (C) + Ar (O) · 2 = 12 + 16 · 2 = 44
Найдём относительную формульную массу NaNO3. Для этого относительную атомную массу натрия складываем с относительной атомной массой азота и относительной атомной массой кислорода, умноженной на три. Подставляем значения относительных атомных масс и получаем 85.
Mr (NaNO3) = Ar (Na) + Ar (N) + Ar (O) · 3 = 23 + 14 + 16 · 3 = 85
 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 9566
9566

