Муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа №18 станица Новомалороссийская
муниципальное образование Выселковский район
ИЗ ОПЫТА РАБОТЫ ПО ПОДГОТОВКЕ
К ИТОГОВОЙ АТТЕСТАЦИИ В 9 КЛАССЕ И
К ЕГЭ ПО ХИМИИ
Михайлец Светлана Святославна
учитель химии
МБОУ СОШ №18
станица Новомалороссийская
МО Выселковский район
2012
В последнее время наблюдается тенденция к повышению роли знаний в жизни человека. Меняется и отношение к качеству образования. Именно качество образования стало ежедневной проблемой. Оценка в аттестате уже не отвечает требованиям при поступлении в ВУЗы, и с каждым годом становится все больше сторонников общероссийской системы оценки качества образования как среди родителей, так и среди выпускников общеобразовательных школ. Работа по поиску эффективных средств и методов организации учебного процесса при подготовке учащихся к единому государственному экзамену и при сдаче экзамена в новой формой в 9 классе велась, мною, в течение нескольких лет, были определены этапы работы:
изучение методической литературы, создание программ для работы с учащимися;
создание для учащихся памяток, инструкций, схем, алгоритмов, базы данных по ЕГЭ – тесты, тренировочные и проверочные работы в бумажном и электронном виде;
использование этого материала в работе по подготовке к ЕГЭ.
прохождение курсов повышения по данной проблеме.
В ходе всей работы я стремлюсь к достижению следующих целей:
- создание оптимальных условий для развития и самореализации индивидуальных и творческих способностей личности школьника, сориентировать на самоорганизацию учебной деятельности;
- формирование творчески мыслящей личности, обладающей прочными базовыми данными, способной адаптироваться к условиям жизни вне школы.
Исходя из целей, определила задачи:
• создать базу опорных знаний для учеников в виде памяток, инструкций, алгоритмов и схем;
• способствовать творческому интеллектуально-познавательному усвоению предметного материала, сделать открытым процесс поиска вида и способа учебной деятельности.
Для повторения основных разделов 8 класса («Периодический закон и Периодическая система химических элементов Д.И. Менделеева», «Виды химической связи», «Свойства классов соединений» и др.) мною используются элементы программированного обучения в системе традиционного обучения. Это облегчает работу по обобщению и систематизации учебного материала.
Как максимально использовать урок для подготовки учащихся к тому, чтобы они смогли продемонстрировать свои знания во время итоговой аттестации?
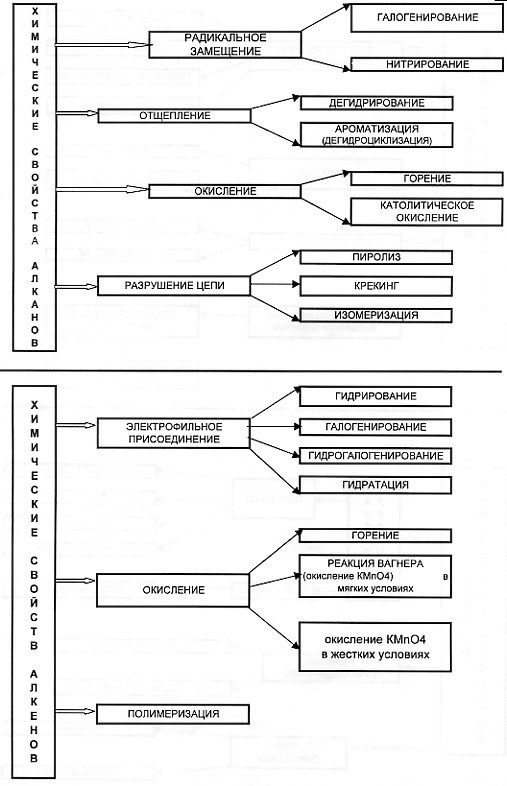
С этой целью на уроках применяю опорные конспекты как один из способов реализации принципа системности и систематичности при изучении химии
В хорошей символической схеме учебный материал «упакован» так, что в устном его озвучивании можно многократно варьировать отдельными частями схемы. Вариативное систематическое повторение позволяет раскрыть учебный материал с разных сторон, держа в памяти всю его целостность и внутреннюю стройность. При этом должны быть как вербально, так и визуально выделены главные и вспомогательные информационные единицы схемы.
На мой взгляд использование таких видов синтетических опор, блоки-схемы, матрично-табличные опоры, синтетические опорные конспекты, повышают эффект обучения.
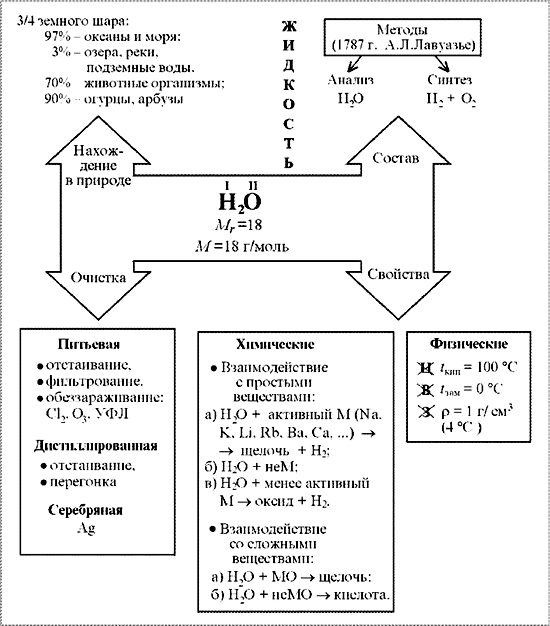
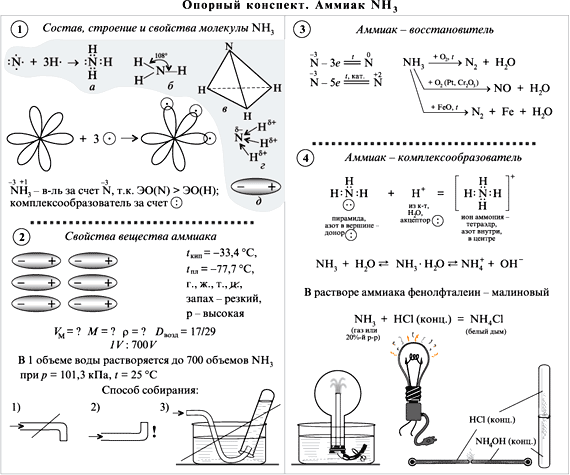
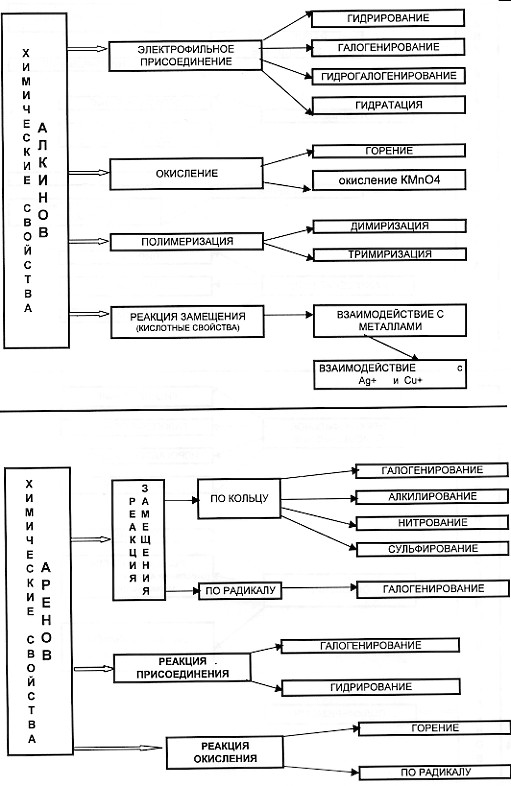
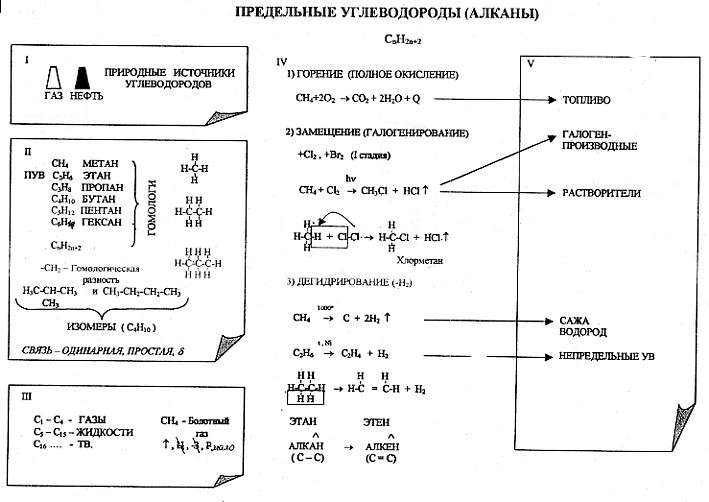
Анализируя «плюсы» и «минусы» итоговой аттестации в 9 классе в новой форме и ЕГЭ, я пришла к выводу, что следует вводить тестовые технологии в систему обучения, с 8 класса, что позволит:
ограничивать время выполнения вопросов теста (поминутно);
обращать внимания учащихся на уровень сложности заданий (разноуровневость);
учить находить выход в ситуации «сложного вопроса», пропуская задание и возвратиться к нему позже;
в некоторых случаях искать правильный вариант ответа «методом исключения»
Тем самым можно не только оценить процент усвоения материала учеником, но и отработать у обучающихся навыки работы с тестовыми заданиями, что, безусловно, может реально повысить балл в ходе сдачи экзамена.
Использование тестологического тематического и итогового контроля в типовых конструкциях тестовых заданий ГИА и ЕГЭ , применяемых на экзамене, позволяет готовить ученика практически не тратить время на понимание инструкции по выполнению заданий, т. к. в таких заданиях формируются психотехнические навыки саморегуляции и самоконтроля. Они позволяют повысить эффективность подготовки к экзамену.
С момента внедрения в практику итоговой государственной аттестации в форме ЕГЭ я готовлю учащихся к сдаче экзамена. Особенные трудности вызывает подготовка к уровню «С».
Одно из заданий высокого уровня сложности (оно входит в третью часть экзаменационной работы - задание С2), проверяет знания о свойствах веществ, в том числе и амфотерных свойствах. В данной статье я хочу изложить в тезисной форме материал, который вызывает затруднения у учащихся из собственного опыта. Знание этого материала поможет учащимся успешно сдать экзамен по химии.
Для успешного выполнения этого задания нужно знать и способы разрушения комплексных солей. В учебной литературе этому материалу уделяется недостаточно внимания. Ни в одном отдельно взятом пособии он подробно не рассматривается.
Оксиды и гидроксиды многих переходных металлов имеют амфотерные свойства. Они нерастворимы в воде, но взаимодействуют и с кислотами, и со щелочами. При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений цинка, бериллия, алюминия, железа, хрома. Рассмотрим основные реакции на примере цинка, алюминия и их соединений.
Основные свойства при взаимодействии с сильными кислотами:
ZnO + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Кислотные свойства при взаимодействии со щелочами:
а) Реакции при сплавлении.
Формулу гидроксида цинка записывают в кислотной форме H2ZnO2 (цинковая кислота).
H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O (цинкат натрия)
ZnO + 2NaOH = Na2ZnO2 + H2O
Кислотная форма гидроксида алюминия H3AlO3 (ортоалюминиевая кислота), но она неустойчива, и при нагревании отщепляется вода: H3AlO3 – H2O = HAlO2, получается метаалюминиевая кислота.
По этой причине при сплавлении соединений алюминия со щелочами получаются соли – метаалюминаты:
Al(OH)3 + NaOH = NaAlO2 + 2H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
б) Реакции в растворе происходят с образованием комплексных солей:
Zn(OH)2 + 2NaOH = Na2 [Zn(OH)4]
ZnO + 2NaOH + 2H2O = Na2[Zn(OH)4] -
тетрагидроксоцинкат натрия.
Al(OH)3 + NaOH = Na[Al(OH)4]
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] -
тетрагидроксоалюминат натрия.
При взаимодействии соединений алюминия со щелочами в растворе получаются разные формы комплексных солей:
Na[Al(OH)4] - тетрагидроксоалюминат натрия,
Na3[Al(OH)6] - гексагидроксоалюминат натрия,
Na[Al(OH)4 (H2O)2] - диакватетрагидроксоалюминат натрия.
Форма соли зависит от концентрации щелочи.
Соединения бериллия - ВеО и Ве(ОН)2 - взаимодействуют со щелочами аналогично соединениям цинка, соединения хрома (III) и железа (III) - Cr2O3, Cr(OH)3, Fe2O3, Fe(OH)3 - аналогично соединениям алюминия, но оксиды этих металлов взаимодействуют со щелочами только при сплавлении.
Cr2O3 + NaOH = NaCrO2 + H2O –
метахромит натрия, хромат (III) натрия.
Fe2O3 + 2NaOH = 2NaFeO2 + H2O –
феррит натрия, феррат (III) натрия.
При взаимодействии гидроксидов этих металлов со щелочами в растворе получаются комплексные соли с координационным числом 6.
Гидроксид хрома (III) легко растворяется в щелочах.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6 –
гексагидроксохромат (III) натрия.
Гидроксид железа (III) имеет очень слабые амфотерные свойства, взаимодействует только с горячими концентрированными растворами щелочей: Fe(OH)3 + 3NaOH = Na3[Fe(OH)6] -
тетрагидроксоферрат (III) натрия.
Из рассматриваемых металлов с растворами щелочей взаимодействуют только Ве, Zn, Al:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 -
тетрагидроксобериллат натрия.
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Железо и хром с растворами щелочей не реагируют, эти реакции возможны только при сплавлении с твёрдыми щелочами.
При рассмотрении способов разрушения комплексных солей можно выделить несколько случаев:
При действии избытка сильной кислоты получается две средних соли и вода:
NaAl(OH)4 + 4HClизб. = NaCl + AlCl3 + H2O
K3Cr(OH)6 + 6HNO3 изб. = 3KNO3 + Cr(NO3)3 + 6H2O
При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода:
NaAl(OH)4 + HClнед. = NaCl + Al(OH)3 + H2O
K3Cr(OH)6 + 3HNO3 нед. = 3KNO3 + Cr(OH)3 + 3H2O
При действии слабой кислоты получается кислая соль активного металла, амфотерный гидроксид и вода:
NaAl(OH)4 + H2S = NaHS + Al(OH)3 + H2O
K3Cr(OH)6 + 3H2CO3 = 3KHCO3 + Cr(OH)3 + 3H2O
При действии углекислого или сернистого газа получается кислая соль активного металла и амфотерный гидроксид:
NaAl(OH)4 + CO2 = NaHCO3 + Al(OH)3
K3Cr(OH)6+ 3SO2 = 3KHSO3 + Cr(OH)3
При действии солей, образованных сильными кислотами и катионами Fe3+, Al3+ и Cr3+ происходит взаимное усиление
гидролиза, получается два амфотерных гидроксида и соль активного металла:
3NaAl(OH)4 + FeCl3 = 3Al(OH)3 + Fe(OH)3 + 3NaCl
K3Cr(OH)6 + Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
При нагревании выделяется вода:
NaAl(OH)4 = NaAlO2 + 2H2O
K3Cr(OH)6 = KCrO2 + 2H2O + 2KOH
Для отработки умений можно выполнить следующие задания:
1. Составить уравнения четырёх возможных реакций между растворами гексагидроксохромата (III) калия, хлорида алюминия, сероводорода, соляной кислоты.
Ответ:
1) K3Cr(OH)6 + AlCl3 = Cr(OH)3 +Al(OH)3 + 3KCl
2) K3Cr(OH)6 + 3H2S = 3KHS + Cr(OH)3 + 3H2O
3) K3Cr(OH)6 + 6HCl изб. = 3KCl + CrCl3 + 6H2O
4) K3Cr(OH)6 + 3HCl нед. = 3KCl + Cr(OH)3 + 3H2O
2. Даны водные растворы гексагидроксохромата натрия, сернистого газа, бромида железа (III), гидроксида натрия.
Напишите уравнения четырёх возможных реакций между ними.
3. Напишите уравнения четырёх возможных реакций между растворами гексагидроксоалюмината калия, карбоната калия, угольной кислоты, хлорида хрома (III).
4. Осуществить превращения:
HCl NaOH NaOH изб. H2SO4 t
ZnO y z y ZnO
KOH Н2O KOH HCl
Al Al(OH)3 y z Al(OH)3
спл.
1. Учащиеся должны чётко знать возможные степени окисления следующих элементов, что позволит им правильно определять степени окисления при составлении уравнений ОВР.
Марганец: +2, +3, +4, +6, +7.
Хром : +2, +3, +6.
Железо: +2, +3, +6.
Азот: -3, 0, +1, +2, +4, +5.
Сера: -2, 0, +4, +6.
Фосфор: -3, 0, +3, +5.
Хлор: -1, 0, +1, + 3, +5, +7.
Учащиеся должны запомнить, что металлы, имеющие высшие степени окисления, образуют кислотные оксиды.
2. Часто в цепочках превращений используется перманганат калия: КМпО4. Это сильный окислитель. Он легко окисляет многие органические вещества, превращает соли железа(2) в соли железа(3), сернистую кислоту в серную, из соляной кислоты выделяет хлор.
Вступая в химические реакции ион МnО4- может восстанавливаться в различной степени:
В кислой среде (рНn2+
В нейтральной среде (рН=7) до МnО2.
В щелочной среде (рН7) до МnО42-
3. Перекись водорода. Степень окисления элемента кислород в перекиси водорода равна
-1, т.е. имеет промежуточное значение между степенью окисления элемента кислорода в воде(-2), и в молекулярном кислороде(0). Поэтому перекись водорода проявляет окислительно-восстановительную двойственность.
Если перекись служит окислителем, то она восстанавливается до воды Н2О.
Если перекись служит восстановителем, то она окисляется до молекулярного кислорода-О2.
3. Из соединений хрома особыми свойствами обладают соли хроматы и дихроматы.
Хроматы(окрашенные в ярко-жёлтый цвет) в кислой среде переходят в дихроматы (оранжевого цвета)., а дихроматы в щелочной среде переходят в хроматы. Данные переходы можно легко показать опытным путём.
Хроматы и дихроматы-сильные окислители и в уравнениях окислительно-восстановительных реакций они меняют степень окисления с +6 до +3.
5. Особые трудности при подготовке к экзамену вызывают соединения хлора. Учащимся необходимо хорошо знать кислоты, которые образует элемент хлор и названия солей этих кисло.
НСlО-хлорноватистая кислота( соли-гипохлориты)
НСlО2-хлористая (соли-хлориты)
НСlО3-хлоноватая (соли-хлораты)
НСlО4-хлорная (соли-перхлораты)
При взаимодействии галогенов со щелочами в холодном растворе образуются гипохлориты, а в горячем-хлораты ( например хлорат калия или бертолетова соль-КСlО3)
6. Если в качестве исходного вещества для проведения ОВР с другими веществами берут концентрированную азотную кислоту, в результате реакции она восстанавливается до оксида азота NO2
Применяю различные виды контроля: индивидуальный опрос, программированный контроль, творческое домашнее задание, химический диктант.
Химический диктант – метод, который относится к письменной форме контроля знаний учащихся. При проведении химических диктантов активизируется мыслительная деятельность учащихся, самопроизвольно запоминаются специальные сведения по предмету. Химический диктант несет дополнительные сведения к изучаемой теме, помогает понять применение химических знаний в производстве, медицине, быту. Он подтверждает связь науки с жизнью, осуществляет межпредметные связи, развивает кругозор, широту и научность взглядов, усиливает мотивацию к изучению предмета.
Химический диктант по органической химии по теме «Углеводороды с алифатической цепью»
Он проводится в 10 классе после изучения тем «Алканы», «Алкены», «Циклоалканы», «Диеновые углеводороды», «Алкины». Он является неплохим оценочным испытанием для проверки знаний учащихся по этим темам, а также позволяет закрепить знания о таких важных понятиях в органической химии, как «гомологи» и «изомеры».
Диктант поводится в течение одного урока и преследует цель обобщить знания учащихся по данному разделу органической химии.
При проведении диктанта возможна организация индивидуальной работы или работы учащихся в парах.
Учащиеся выписывают в столбик основные понятия темы «Углеводороды» - алканы, алкены, диены, алкины, циклоалканы, изомеры, гомологи. Учитель зачитывает утверждение о том или ином понятии. Учащиеся напротив каждого понятия ставят номер того утверждения, которое, по их мнению, характеризует данный термин. Затем в конце диктанта проводится проверка знаний и соответствие ответов учащихся правильным ответам.
Алканы (2, 5, 16)
Алкены (3, 8, 9, 10)
Алкины (3, 6, 9, 10, 13, 14)
Диены (3, 8, 10, 11, 14)
Циклоалканы (3, 7, 15)
Изомеры (1, 12)
Гомологи(4)
Вещества, имеющие одинаковый качественный состав, но разное строение и свойства. (изомеры)
Эти углеводороды по-другому называют парафины. (алканы)
Для этих углеводородов характерны реакции присоединения. (алкены, алкины, циклоалканы, диены)
Соединения, сходные по химическим свойствам, состав которых отличается друг от друга на одну или несколько групп CH2, называется. (гомологи)
Представитель этого ряда углеводородов называется болотным газом, потому что выделяется со дна болот. (метан - алканы)
Вещество, необходимое для проведения реакции Кучерова. Оно относится к следующему ряду углеводородов. (ацетилен - алкины)
Предельные углеводороды с замкнутой цепью называются... (циклоалканы)
Для этих углеводородов характерно явление SP2 - гибридизации.. (алкены, диены)
Углеводороды, обесцвечивающие раствор бромной воды... (алкены, алкины)
Углеводороды, вступающие в реакцию полимеризации... . (алкены, диены, алкины)
Производные этих углеводородов являются основным сырьём для получения каучука./ (диены)
Вещества бутин и бутадиен являются по отношению друг к другу… (изомерами)
Это вещество можно получить двумя способами, один из которых. называется карбидным. К какому ряду углеводородов оно относится.. (ацетилен, алкины)
Углеводороды, имеющие в своём составе 2 связи... (алкины, диены)
Другое название этих углеводородов нафтены (циклоалканы)
Общая формула этих углеводородов CnH2n+2. (алканы)
Химический диктант по органической химии по теме. «Обобщение знаний об основных кислородсодержащих органических соединениях»
Диктант проводится в начале учебного года в 11 классе при повторении учебного материала 10 класса и в 10 классе при закреплении знаний о кислородсодержащих органических соединениях. Он позволяет оценить знания учащихся о свойствах, получении и применении кислородсодержащих органических соединений.
Учащиеся записывают в столбик следующие термины, обозначающие названия органических веществ: спирты, альдегиды, карбоновые кислоты, простые эфиры, сложные эфиры, фенол, толуол.
Учитель зачитывает утверждения - вопросы. Учащиеся должны записать номер утверждения напротив того класса или классов соединений, для которых, по их мнению, оно справедливо.
После проведения диктанта проверка результатов может осуществляться как самим учителем, так и отдельными учащимися.
Возможна также организация работы в парах для отдельных учащихся.
Диктант позволяет разнообразить знания учащихся о применении органических соединений и тесно связан с жизнью.
Применение данной методической разработки вполне оправдано и дает неплохие результаты при проверке знаний учащихся.
Cпирты .(3, 7, 16.)
Альдегиды .(1, 8, 11, 14.)
Карбоновые кислоты .(1, 2, 6, 12, 17.)
Простые эфиры. (4, 13.)
Сложные эфиры .(5.)
Фенол .(10, 14, 15.)
Толуол .(9, 15.)
Эти соединения содержат в своем составе карбонильную группу.. (альдегиды, карбоновые кислоты)
Соединения, молекулы которых содержат карбоксильную группу, называются.... (карбоновые кислоты)
При дегидратации этих соединений образуются простые эфиры. Например, диэтиловый эфир. (спирты)
Представителя этого класса соединений часто используют в медицине для наркоза. (диэтиловый эфир - простые эфиры)
Эти сложные органические соединения образуются при взаимодействии карбоновых кислот и спиртов. (сложные эфиры)
Это вещество незаменимо при консервировании овощей. Оно относится к классу... (уксусная кислота - карбоновые кислоты)
Представители этого класса органических соединений имеют общую формулу СпН2п+1ОН. (спирты)
Эти органические соединения дают реакцию «серебряного зеркала» и образуются при окислении спиртов(альдегиды)
Сильно взрывчатое вещество тротил является производным этого соединения. (толуол)
Это соединение относят к ароматическим спиртам. (фенол)
Представитель этого класса соединений широко используется в медицине под названием формалин. (40 % - ный водный раствор формальдегида, класс альдегиды)
Как и их неорганические аналоги представители этого класса веществ легко взаимодействуют с металлами, оксидами металлов и основаниями. (карбоновые кислоты)
Общая формула этих соединений R-O-R. (простые эфиры)
Эти соединения хорошо используются при производстве смол и пластмасс. (фенолформальдегидные смолы - фенол, альдегиды)
В структурных формулах молекул этих соединений присутствует бензольное кольцо. (фенол, толуол)
Эти соединения имеют суффикс ол в названиях. (спирты)
Это соединение широко используется для производства мыла. (стеариновая кислота С17Н35СООН - карбоновые кислоты)
Химический диктант по неорганической химии по теме «Обобщение знаний об основных классах неорганических соединений»
После изучения темы «Основные классы неорганических соединений» в 8 классе проводится химический диктант, позволяющий проверить знания учащихся о свойствах оксидов, кислот, оснований и солей. Он развивает у учащихся способность легко различать формулы оксидов, оснований, кислот, солей, а также закрепляет знания учащихся по данной теме.
Учитель записывает на доске изученные термины и зачитывает утверждения, в которых говорится о данных соединениях. Учащиеся записывают номер того утверждения, которое соответствует данному термину. На выполнение задания отводится 10 - 15 минут.
Оксиды (2,3,5,12,13,15)
Основания (4,7)
Кислоты (6, 14)
Соли (1,3,9,11)
Щелочи (4,7,8)
Представитель этой группы веществ часто используется для приготовления пищи и носит название хлорид натрия. (соль - NaCl)
Эти соединения образуются при горении простых веществ. (оксиды)
Продукты реакций взаимодействия кислот и оснований относятся к классам... (оксиды - H 2O, соли)
Вещество едкое кали относится к этому классу соединений. (основания, щелочи)
Они бывают кислотные, основные, амфотерные. (оксиды)
При растворении SO2 в воде образуется соединение, которое относится к классу... (кислот - H2SO3 - сернистая кислота)
Эти соединения состоят из атомов металлов и гидроксильных групп. (основания, щелочи)
Растворимые в воде основания называются... (щелочи)
Эти соединения делятся на 3 группы. Бывают кислые, основные и средние... (соли)
Соединения этого класса веществ используются под названием «сода» в быту. (соли - Na2CO3; NaHCO3)
Соединения, состоящие из атомов металлов и кислотных остатков, носят название... (соли)
Соединения, общий состав которых выражается общей формулой RxOy, называются... (оксиды)
Эти соединения образуются при разложении нерастворимых в воде оснований. (оксиды)
С этими веществами могут реагировать не все металлы, а лишь некоторые, стоящие до водорода в ряду активности металлов, способные выделять его в свободном виде. (кислоты)
При восстановлении этих соединений водородом образуются чистые металлы. (оксиды)
Диктант может быть предложен учащимся при повторении курса неограниченной химии 8 класса на первых уроках в 9 классе.
Результаты и проверка диктанта проходят совместно с учащимися: исправляются ошибки, неточности.
Итоговый контроль осуществляю в форме зачета или контрольной работы.
Зачетом, как правило, завершаю изучение наиболее крупной темы.
Предлагаю вашему вниманию диагностическую карту по подготовке к ЕГЭ по химии, в которой я постаралась отразить все виды работ с учеником.
Диагностическая карта подготовки к единому государственному экзамену по химии
Ученицы(ка) 11 класса _________________________
| № | тема | Блок ЕГЭ | вид работы и дата её проведения |
| консультация | доп.занятие | урок, карточка | Д/З | тест |
| 1 | Строение атома.
| А1 |
|
|
|
|
|
| 2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева. | А2 |
|
|
|
|
|
| 3 | Химическая связь.
| А3 |
|
|
|
|
|
| 4 | Электроотрицательность. Степень окисления.
| А4 В2 |
|
|
|
|
|
| 5 | Строение веществ.
| А5 |
|
|
|
|
|
| 6 | Классификация неорганических соединений. | А6 В1 |
|
|
|
|
|
| 7 | Металлы.
| А7 В5 |
|
|
|
|
|
| 8 | Неметаллы.
| А8 В5 |
|
|
|
|
|
| 9 | Оксиды.
| А10 |
|
|
|
|
|
| 10 | Гидроксиды.
| А11 |
|
|
|
|
|
| 11 | Соли.
| А12 |
|
|
|
|
|
| 12 | Генетическая взаимосвязь неорганических веществ. | А13 С2 |
|
|
|
|
|
| 13 | Теория строения органических веществ.
| А14 |
|
|
|
|
|
| 14 | Классы органических соединений. | А15 А17 |
|
|
|
|
|
| 15 | Генетическая взаимосвязь органических соединений. | А18 С3 |
|
|
|
|
|
| 16 | Классификация химических реакций. | А19
|
|
|
|
|
|
| 17 | Скорость реакции. | А20
|
|
|
|
|
|
| 18 | Химическое равновесие.
| А21
|
|
|
|
|
|
| 19 | Электролитическая диссоциация. | А22
|
|
|
|
|
|
| 20 | Реакции ионного обмена. | А23
|
|
|
|
|
|
| 21 | Окислительно-восстановительные реакции.
| А24 С1 |
|
|
|
|
|
| 22 | Гидролиз солей. | А25 В4 |
|
|
|
|
|
| 23 | Правила работы в лаборатории. | А28
|
|
|
|
|
|
| 24 | Химическое производство и охрана ОС. | А29
|
|
|
|
|
|
| 25 | Объемные отношения газов в реакции. | А30
|
|
|
|
|
|
| 26 | Тепловой эффект химической реакции. | А30
|
|
|
|
|
|
| 27 | Электролиз. | В3
|
|
|
|
|
|
| 28 | Характерные химические свойства неорганических веществ. | В5
|
|
|
|
|
|
| 29 | Характерные химические свойства органических веществ. | А26 А27 |
|
|
|
|
|
| 30 | Характерные химические свойства органических веществ. | В6 В7 |
|
|
|
|
|
| 31 | Вычисление массы растворенного вещества по известной массе раствора и массовой доле вещества. | В9
|
|
|
|
|
|
| 32
| Расчеты массы и объема вещества по одному из участвующих в реакции веществ. | В10
|
|
|
|
|
|
| 33 | Расчет массы продуктов реакции, если одно из веществ дано в избытке. | С4
|
|
|
|
|
|
| 34 | Нахождение молекулярной формулы вещества. | С5
|
|
|
|
|
|
СОВРЕМЕННЫЕ ОБРАЗОВАТЕЛЬНЫЕ ТЕХНОЛОГИИ И ИХ ПРИМЕНЕНИЕ НА УРОКАХ ХИМИИ.
(из опыта работы учителя химии Беловой Людмилы Викторовны)
В настоящее время к выпускникам средних школ предъявляются большие требования при поступлении в высшие учебные заведения. Ребятам окончившим школу необходимо адаптироваться в сложном современном мире: им нужны не только полученные знания, но и умения их находить самим, ощущать себя компетентными людьми в любой области, творчески мыслящими, чтобы успешно утвердиться в жизни. В результате многолетней работы в школе, я пришла к выводу, что добиться хороших успехов в обучении можно только путем повышения интереса к своему предмету. Наверно, одной из причин потери этого интереса являются некоторые традиционные приемы и методы обучения. Освоение химии приходится в школе на 13 -16 лет, когда ребята пребывают в так называемом “кризисном” периоде. В этот период особенно развито чувство самосознания и собственного достоинства. В этом возрасте происходит изменение процессов психического развития, перестройка прежних отношений к миру к себе, возникает потребность в самоопределении и самовыражении. У подростка вызывает скуку и раздражение авторитарный нажим, приказ. Я считаю, в современной школе очень важен личностный подход, работать с каждым в зоне его ближайшего развития. Переходный период часто у детей протекает с обострениями хронических заболеваний, что вызывает применение на уроках здоровьесберегающих технологий. Одним из важных моментов на уроке для ребенка является понимание необходимости личной заинтересованности в приобретении знаний, чтобы учащиеся могли ощущать свою компетентность не только в результате, но и на протяжении всего процесса обучения. Я думаю, что в этом и есть условие развивающего воздействия обучения на личность учащегося. Поэтому современный урок, по – моему, должен построен в сочетании специально организованной деятельности и обычного межличностного общения (готовность ребенка к контакту, доверительность, заинтересованность), таким образом через личностный план общения на уроке реализуется учет возрастных, психологических особенностей учащихся: их готовность к расширению круга общения, к сопереживанию проблем взрослых, стремление к самоутверждению. Достичь поставленных целей мне помогают современные образовательные технологии, такие как
Современные технологии позволяют формировать и развивать предметные и учебные знания и умения в процессе активной разноуровневой познавательной деятельности учащихся в условиях эмоционально – комфортной атмосферы, развивать положительную мотивацию учения. Например, одним из элементов технологии организации адаптационно-развивающих диалогов на моих уроках химии является использование химического тренажера, который позволяет применять предметные знания и умения, развивать навыки использования химической номенклатуры, классификации, основных химических понятий (наиболее эффективно его применение при изучении основных классов неорганической и органической химии).Применение химического тренажера развивает у ребят умение участвовать в общем диалоге. Осуществлять само- и взаимоконтроль, самопроверку, формировать адекватную самооценку. Работа в динамических парах и малых группах позволяет соотносить свою деятельность с деятельностью остальных, ребенок может провести не только самооценку, но и самокоррекцию.
В настоящее время в педагогический лексикон прочно вошло понятие педагогической технологии. Однако в его понимании и употреблении существуют большие разночтения. Рассмотрим понятие «технология». Технология - это совокупность приемов, применяемых в каком-либо деле, мастерстве, искусстве (толковый словарь). Также существует множество определений, данных различными учеными:
• Педагогическая технология - совокупность психолого-педагогических установок, определяющих специальный набор и компоновку форм, методов, способов, приемов обучения, воспитательных средств; она есть организационно-методический инструментарий педагогического процесса (Б.Т.Лихачев).
• Педагогическая технология - это содержательная техника реализации учебного процесса (В.П.Беспалько).
• Педагогическая технология - это описание процесса достижения планируемых результатов обучения (И.П.Волков).
• Технология - это искусство, мастерство, умение, совокупность методов обработки, изменения состояния (В.М.Шепель).
• Технология обучения - это составная процессуальная часть дидактической системы (М.Чошанов).
• Педагогическая технология — это продуманная во всех деталях модель совместной педагогической деятельности по проектированию, организации и проведению учебного процесса с безусловным обеспечением комфортных условий для учащихся и учителя (В.М.Монахов).
• Педагогическая технология - это системный метод создания, применения и определения всего процесса преподавания и усвоения знаний с учетом технических и человеческих ресурсов и их взаимодействия, ставящий своей задачей оптимизацию форм образования (ЮНЕСКО).
• Педагогическая технология означает системную совокупность и порядок функционирования всех личностных, инструментальных и методологических средств, используемых для достижения педагогических целей (М.В.Кларин)». [Селевко Г.К. Современные образовательные технологии: Учебное пособие. – М.: Народное образование, 1998. – C. 14-15]
Определение «педагогической технологии» в нашем понимании педагогическая технология является содержательным обобщением, вбирающим в себя смыслы всех определений различных авторов (источников).
Понятие «педагогическая технология» может быть представлено тремя аспектами.
1) научным: педагогические технологии - часть педагогической науки, изучающая и разрабатывающая цели, содержание и методы обучения и проектирующая педагогические процессы;
2) процессуально-описательным: описание (алгоритм) процесса, совокупность целей, содержания, методов и средств для достижения планируемых результатов обучения;
3) процессуально-действенным: осуществление технологического (педагогического) процесса, функционирование всех личностных, инструментальных и методологических педагогических средств.
Таким образом, педагогическая технология функционирует и в качестве науки, исследующей наиболее рациональные пути обучения, и в качестве системы способов, принципов и регулятивов, применяемых в обучении, и в качестве реального процесса обучения.
Каждый учитель хочет, чтобы его предмет вызывал глубокий интерес у школьников, чтобы ученики умели не только писать химические формулы и уравнения реакций, но и понимать химическую картину мира, умели логически мыслить, чтобы каждый урок был праздником, доставляющим радость и ученикам и учителю. Мы привыкли, что на уроке учитель рассказывает, а ученик слушает и усваивает. Слушать готовую информацию – один из самых неэффективных способов учения. Знания не могут быть перенесены из головы в голову механически (услышал – усвоил). Отсюда делаем вывод, что необходимо сделать из ученика активного соучастника учебного процесса. Ученик может усвоить информацию только в собственной деятельности при заинтересованности предметом. Поэтому учителю нужно забыть о роли информатора, он должен исполнять роль организатора познавательной деятельности ученика. Итак, учитель должен организовать на уроке для ученика все виды учебно-познавательной деятельности. Первая – это деятельность с объектом изучения. Для химии таким объектом является вещество, проведение опытов. Опыты могут проводить ученики или демонстрироваться учителем. Вторая – это деятельность с материальными моделями молекул, кристаллическими решетками, химическими формулами, решение химических задач, сопоставление физических величин, характеризующих изучаемые вещества. Проводя опыты, составляя химические формулы и уравнения, сопоставляя цифровой материал, ученик делает выводы, систематизирует факты, устанавливает определенные взаимосвязи, проводит аналогии и т.д.
Необходимо, чтобы учебно-познавательная деятельность ученика соответствовала тому учебному материалу, который должен быть усвоен. Необходимо, чтобы в результате деятельности, ученик самостоятельно приходил к каким-либо выводам, чтобы сам для себя созидал знание.
Важнейшим принципом дидактики, является принцип самостоятельного созидания знаний, который заключается в том, что знание учеником не получается в готовом виде, а созидается им самим в результате организованной учителем определенной познавательной деятельности.
Следовательно, развитию познавательных и творческих интересов у учащихся способствуют различные виды технологий: технология уровневой дифференциации обучения компьютерные технологии, групповые технологии, технология проблемного и исследовательского обучения, технология игрового обучения, использование тестов.
На своих уроках я применяю следующие педагогические технологии:
1.Педагогические технологии на основе эффективности управления и организации учебного процесса:
2. Педагогические технологии на основе активизации и интенсификации деятельности учащихся:
3. Педагогические технологии на основе личностной ориентации педагогического процесса:
Познакомимся подробнее с некоторыми из них.
Педагогические технологии, которые я использую в своей педагогической деятельности:
Технология уровневой дифференциации на на основе обязательных результатов (В.В.Фирсов).
Компьютерные технологии. (Бронников В.М.)
Проектно-исследовательская технология
(Д. Дьюи, И. А. Сасова)
Технология интесификации обучения на основе схемных и знаковых моделей учебного материала (В.Ф.Шаталов)
Игровые технологии.
I.Педагогические технологии на основе эффективности управления и организации учебного процесса:
1. Уровневая дифференциация обучения на основе обязательных результатов (В.В.Фирсов)
В данной технологии предлагается введение 2 стандартов : для обучения (уровень, который должна обеспечить школа интересующемуся, способному выпускнику) и стандарта обязательной общеобразовательной подготовки (уровень, которого должен достичь каждый). Добровольное восхождение от обязательного к повышенным уровням способно реально обеспечить школьнику постоянное пребывание в зоне ближайшего развития, обучение на индивидуальном максимально посильном уровне.
Целевые ориентации.
1. Обучение каждого на уровне его возможностей и способностей.
2. Приспособление обучения к особенностям различных групп учащихся.
Особенности содержания.
Наличие стандартов базовых образовательных областей, состоящих из двух уровней требований :
1. К содержанию образования, которое школа обязана предоставить учащемуся.
2. К содержанию образования, которое школа должна потребовать от учащегося, и усвоение которого является минимально обязательным для учащегося.
В связи с этим уровневая дифференциация обучения предусматривает :
- наличие базового обязательного уровня общеобразовательной подготовки ;
- базовый уровень является основой для дифференциации и индивидуализации требований к учащимся ;
- базовый уровень должен быть реально выполним для всех учащихся ;
- система результатов, которых должен достичь по базовому уровню учащийся, должна быть открытой (ученик знает, что с него требуют ) ;
- на ряду с базовым уровнем учащемуся предоставляется возможность повышенной подготовки.
Особенности методики.
- блочная подача материала ;
- работа с малыми группами на нескольких уровнях усвоения ;
- наличие учебно-методического комплекса : банк заданий обязательного уровня, система специальных дидактических материалов, выделение обязательного материала в учебниках.
Основное условие уровневой дифференциации по В.В. Фирсову - систематическая повседневная работа по предупреждению и ликвидации пробелов путем организации пересдачи зачетов.
Оценивание знаний.
Альтернативой традиционному способу оценки «вычитанием» является «оценка методом сложения», в основу которой кладется минимальный уровень общеобразовательной подготовки, достижение которого требуется в обязательном порядке от каждого учащегося. Критерии более высоких уровней строятся на базе учета того, что достигнуто сверх базового уровня, и системы зачетов.
Предусматривается :
- тематический контроль ;
- полнота проверки обязательного уровня подготовки ;
- открытость образцов проверочных заданий обязательного уровня ;
- оценка методом сложения (общий зачет – сумма частных зачетов) ;
- двоичность в оценке обязательного уровня (зачет – незачет);
- повышенные оценки за достижения сверх базового уровня ;
- «закрытие» пробелов (досдача, а не пересдача) ;
- возможность «дробных» зачетов ;
- кумулятивность итоговой оценки (годовая оценка вытекает из всех полученных).
Зачеты проводятся в учебное время, при этом :
- предусматривается резерв времени для доработки ;
- возможна помощь учителя во время зачета ;
- учащимся даются «ключи» к проверочным знаниям ;
- на каждого ведется лист учета и контроля ;
- в случае, если учащийся претендует на оценки «4» и «5» , итоговый контроль предусматривает экзамен «на подтверждение» по всему материалу. Эффективная организация обучения невозможна без использования индивидуально-дифференцированного подхода к ученикам. Учителю необходимо учитывать познавательные интересы всех учащихся, развивать каждого в меру его сил и способностей. В обучении химии разноуровневая дифференциация имеет особое значение. Это обусловлено спецификой учебного предмета: у одних учащихся усвоение химии сопряжено со значительными трудностями, а у других проявляются явно выраженные способности к изучению этого предмета. В данной ситуации учителю важно учитывать как познавательные интересы учащихся, так и индивидуальный темп их развития. Такой подход основан на многоуровневом планировании результатов обязательной подготовки учащихся (усвоение минимума) и формировании повышенных уровней овладения материалом. Учащиеся получают право и возможность выбирать уровень обучения, учитывая свои способности, интересы, потребности, варьировать свою учебную нагрузку, учиться адекватно оценивать свои знания. В процессе обучения дифференциация осуществляется, прежде всего, через применение разноуровневых заданий для учащихся, выполняемых на уроке с целью закрепления знаний, в качестве контрольных заданий на зачетах, контрольных работах. Дифференциация в обучении открывает перед учащимися возможности выбора уровня обучения, а вместе с ним и уровня теоретической и практической подготовки по химии. В процессе управления учитель ищет способы, как направлять, корректировать работу учеников, вовремя приходить на помощь отстающим. Он проявляет заботу не только о том, как усваивается учебный материал, формируется умения и навыки, но и как развиваются, воспитываются ученики.
Формы использования в образовательном процессе:
Взаимообучение и взаимо-контроль в условиях работы пар.
Работа с разноуровневыми тестами.
Выполнение практических заданий разного уровня.
Творческие групповые задания для подготовки к семинарам и деловым играм, урокам-конкурсам.
Зачет по проверке базовых знаний в различных формах
Например, дифференцированная контрольная работа. Обучающиеся получают индивидуальные карточки, ученики со слабыми знаниями выполняют задания невысокого уровня сложности ( 2 или 3 задания). Более сильные ученики решают четыре или пять заданий карточки, позволяющих проверить не только практические, но и теоретические знания. Соответственно, уровень А оценивается на 3 балла, уровень В – 4 балла, уровень С – 5 баллов. Но обучающиеся могут получить и более высокую оценку, ответив устно, или выполнив дополнительные задания.
Используются в работе и тестовые задания, состоящие из нескольких уровней. При их создания используются как закрытые, так и открытые задания. Для того чтобы исключить вероятность угадывания правильного ответа, вариантов ответов должно быть не меньше четырех. А открытые задания необходимы для проверки более глубоких знаний. Тестовые задания составляются приближенно к итоговой аттестации (ГИА или ЕГЭ), для того чтобы учащиеся заранее подготовиться к экзаменам и предстоящее тестирование не вызывало страха.
Многократное повторение близких по содержанию знаний понятий, безусловно, способствует более прочному и осмысленному пониманию главнейших теоретических положению курса, более активному приобретению навыков и умений. Для того чтобы обучающиеся могли применять химические знания, составляются задачи с профессиональным содержанием.
При решении расчетных задач, также учитывается уровень знаний и способностей учащихся. Одну и ту же задачу можно решить разными способами, и существуют методические разработки, в которых учитывается правостороннее и левостороннее развитие ученика. Также мною были составлены карточки с заданиями для каждого ученика, что заставляет, не надеется на списывание у соседа, а решить все самому.
Разноуровневый подход используется и при задании домашней работы. Учащимся задается определенное количество заданий (задачник). Из них он может выполнить обязательный минимум, а также свыше этого минимума. Важный психологический эффект: самостоятельный выбор задания дает дополнительную возможность самореализации ученику, и предмет становится ему интереснее. Из всех заданий ученик выбирает тот уровень сложности, на который способен «замахнуться», и таким образом сам как бы отслеживает уровень своей компетентности. И, наконец, выбирая свои задачи, ученик волей-неволей читает остальные. Таким образом, его учебный кругозор становится шире, то есть он знает гораздо больше задач, чем решает, а также учится с первого взгляда оценивать сложность задачи.
Таким образом, основная цель разноуровневой дифференциации состоит в том, чтобы создать условия для самореализации каждого ученика в соответствии с его интересами и, главное, возможностями. Эта технология позволяет учащимся реально оценивать свои силы, а также видеть свои достижения. В результате повышается интерес к предмету, между учителем и учащимися устанавливаются партнерские отношения, снижается психологическое напряжение учащихся на уроках. Повышается качество знаний и активность слабоуспевающих учащихся.
Никто не оспаривает тот факт, что химия – это очень важная наука. Но она скучна, если опирается только на научные достижения и факты. Модернизация образования предполагает ориентацию не только на усвоение каждым обучающимся определенной суммы знаний, но и на развитие его личности, познавательных и созидательных способностей. Очень важным при этом является практическое применение полученных на уроках знаний в повседневной жизни, окружающем мире.
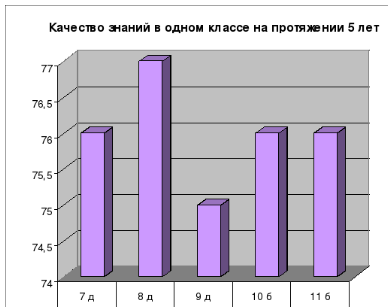
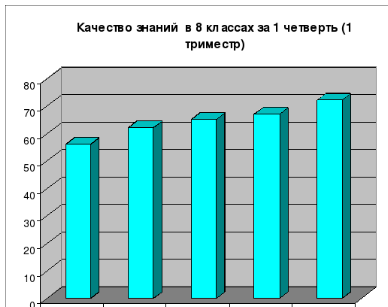
Результаты: 100% обученность учащихся и постоянное повышение качества знаний:
2. Компьютерные технологии.
Цели: Формирование умений обработки информации; развитие коммуникативных способностей; подготовка личности «информационного общества»; формирование исследовательских УУД, умения принимать оптимальные решения; максимально наглядная подача учебного материала. В зависимости от формы, целей и задач урока компьютерные технологии применяются как:
источник учебной информации (частично или полностью заменяющий учителя или книгу);
наглядное пособие, используя возможности мультимедиа и телекоммуникации;
тренажёр;
средство диагностики и контроля.
Компьютерные технологии используются на всех этапах процесса обучения:
при объяснении нового материала (источник учебной информации),
при повторении (дидактические материалы);
для контроля знаний (тесты),
с целью организации досуговой среды.
Использование компьютерных технологий даёт неограниченные возможности для самостоятельной и совместной творческой деятельности учащихся и учителя. Использование компьютера и мультимедийных технологий дают положительные результаты при объяснении нового материала, моделировании различных ситуаций, при сборе нужной информации, при оценке ЗУН и т. д., а также позволяют на практике реализовать такие методы обучения, как: деловые игры, упражнения по решению проблем, презентации и прочее.
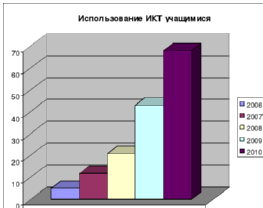
Результаты использования ИКТ:
Создан банк данных (компьютерные презентации учащихся 8, 9, 10, 11 классов) и компьютерные презентации учителя ( по темам)
Положительные результаты итоговой аттестации учащихся 9 классов (экзамен по выбору в традиционной форме) и 11 классов ( до 2010 года)
Успешное выступление на научно-практических конференциях
Ежегодно повышается активность учащихся в использовании ИКТ при подготовке уроков и внеклассных мероприятий
Выступления на ШМО, педсоветах, семинарах для учителей
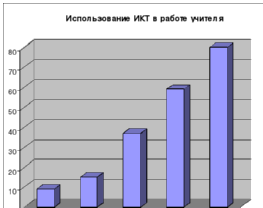
Компьютерная технология дает возможность располагать таким объемом информации, которым не владеют учителя, опирающиеся на традиционные методы обучения. В мультимедийных обучающих программах используются анимации и звуковое сопровождение, которые, воздействуя сразу на несколько информационных каналов обучаемого, усиливают восприятие, облегчают усвоение и запоминание материала. На своих уроках использую различные программы на компакт дисках, которые помогают мне для объяснения новых или повторения старых тем, закрепить и систематизировать полученные знания. Пример одного урока. Тема: “Подгруппа кислорода, характеристика. Получение кислорода”. В процессе урока использовался мультимедиа проектор, где на экране демонстрировались опыты, которые в школьной лаборатории продемонстрировать невозможно. Так же на экране проектировались несколько таблиц. Ребятам предлагалось проанализировать, сравнить и сделать вывод. Из вышесказанного приходим к выводу, что компьютерная технология повышает уровень обучения и вызывает интерес учащихся к предмету. Мною создана копилка компьютерных презентаций к урокам, также в классе имеется коллекция компьютерных дисков, пособий для применения на уроках, а также есть уроки, на которых учащиеся защищают свои проекты-презентации, например тема 9 класса «Химические производства», что повышает интерес к предмету, дает возможность повышать свои знания в области ИКТ, работать с Интернет как источником получения и закрепления знаний, отрабатываются умения работать с аудиторией и представлять свою работу.
3.Проектно-исследовательская технология
(Д. Дьюи, И. А. Сасова)
Технология исследовательского обучения. Цели:
Формирование активной, самостоятельной, инициативной позиции обучающихся в учении.
Развитие познавательного интереса учащихся
Исследовательская деятельность школьников – это совокупность действий поискового характера, ведущих к открытию неизвестных фактов, теоретических знаний и способов деятельности. Таким путем учащиеся знакомятся с основными методами исследования в химии, овладевают умениями самостоятельно добыть новые знания, постоянно обращаясь к теории. Привлечение опорных знаний для решения проблемных ситуаций предполагает формирование и совершенствование как общеучебных, так и специальных умений учащихся (проводить химические опыты, соотносить наблюдаемые явления с изменениями состояния молекул, атомов, ионов, проводить мысленный химический эксперимент, моделировать сущность процессов и т. п.).
В процессе подготовки проекта проводятся такие уроки, как: урок-эксперимент, урок-исследование, интегрированный урок-семинар. Используются частично-поисковый метод, метод гипотез, мини-проекты и др. В процессе работы над проектами осуществляются направление деятельности учащихся и консультации с ними.
Результаты проектной деятельности (индивидуальной или групповой) рассматриваются на уроке-защите проектов, интегрированном уроке-семинаре.
Проектная деятельность активно используется и во внеклассной работе
Исследование может проводиться с целью получения новых знаний, обобщения, приобретения умений, применять полученные знания, изучения конкретных веществ, явлений, процессов. Так, при изучении темы “Соли азотной кислоты” в 9-ом классе использую элементы исследовательской работы. Исследование включает: проведение теоретического анализа; прогнозирование способов получения веществ и их свойств; составление плана экспериментальной проверки и его выполнение; формулирование вывода. Получается логическая цепочка: теоретический анализ – прогнозирование – эксперимент. Майкл Фарадей говорил: “Ни одна наука не нуждается в эксперименте в такой степени как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опытом необходим”. Для систематизации получаемых знаний учащиеся заполняют таблицу:
Соли азотной кислоты
| План урока | Теоретический анализ | Прогнозирование | Эксперимент | Задание на дом |
Исследовательская работа учащихся занимает на уроке больше времени, чем выполнение заданий по образцу. Однако затраты времени впоследствии компенсируются тем, что учащиеся быстро и правильно выполняют задания, могут самостоятельно изучать новый материал. Кроме того, повышается осознанность и прочность их знаний, появляется устойчивый интерес к предмету. Исследовательская деятельность проводится не только на уроках, но и во внеурочной деятельности. Учащиеся активно разрабатывают научно-практические работы и принимают участие в школьной и городской научно –практической работе. Результаты применения технологии:
2006-2007 уч. год –12 %
2007-2008 уч. год –25 %
2008-2009 уч. год –36 %
2009-2010 уч. год –41 %
2010-2011 уч. год –49 %;
Данная технология позволяет учащимся реально оценивать свои возможности;
повышается интерес к предмету;
между учителем и учащимися устанавливаются партнерские отношения;
снижается психологическое напряжение учащихся на уроках;
повышается качество знаний и активность слабоуспевающих учащихся;
исчезает страх перед проверкой знаний.
II. Педагогические технологии на основе активизации и интенсификации деятельности учащихся:
1. Игровые технологии.
Интеллектуально-творческие игры (ИТИ) стимулируют развитие познавательных интересов учащихся, способствуют развитию их интеллектуально-творческих способностей, дают возможность ребятам самоутвердиться и реализовать себя в интеллектуально-творческой сфере через игру, помогают восполнить дефицит общения. ИТИ могут быть использованы не только во внеклассной и внеурочной работе, но и на уроках (при изучении нового материала, повторении пройденного, контроля знаний учащихся и т. д.). Дидактическая игра позволяет эффективно реализовывать все ведущие функции обучения: образовательную, воспитательную и развивающую на основе принципов педагогики сотрудничества. Осуществляется более свободный, психологически раскрепощенный контроль знаний. Исчезает болезненная реакция учащихся на неудачные ответы. Подход к учащимся в обучении становится более деликатным и дифференцированным. В результате стимулируется познавательная деятельность учащихся; активизируется мыслительная деятельность; самопроизвольно запоминаются специальные сведения; формируется ассоциативное запоминание; решаются проблемные вопросы; выявляются личностные черты характера ученика; усиливается мотивация к изучению предмета.
Оправданно и эффективно использование методов активного обучения: игр, занимательной дидактики, ролевых, сюжетных постановок, что вносит непринужденную обстановку в урок и позволяет успешно реализовывать поставленные цели и задачи.
Дидактическая игра позволяет эффективно реализовывать все ведущие функции обучения: образовательную, воспитательную и развивающую на основе принципов педагогики сотрудничества.
Какие задачи решает использование такой формы обучения?
Осуществляется более свободный, психологически раскрепощенный контроль знаний.
Исчезает болезненная реакция учащихся на неудачные ответы.
Подход к учащимся в обучении становится более деликатным и дифференцированным.
Составлена картотека дидактических игр: «Химический аукцион», «Химическое лото», «Химия в твоих руках», «Своя игра» и др.
Интерактивные методы – это те методы, которые требуют взаимодействия между обучающимися, а также между учащимся и учителем.
Открытый урок «Москву прославили металлы»» был проведен в форме интерактивного ток-шоу. Роль учителя заключалась в направлении работы обучающихся в нужное русло. Обучающиеся были и главными героями, и экспертами, и специалистами, и журналистами, и актерами, а также активными зрителями.
Интенсивность развития мышления связана с развитием творческого ресурса, что особенно важно в познавательной деятельности.
Урок-турнир «Крахмал и целлюлоза: состав, строение, свойства, применение» строился на сравнении двух углеводов. Обучающиеся были поделены на две команды, которые доказывали, что их углевод самый достойный. Были использованы компьютерные технологии (презентации по темам с демонстрацией химических опытов), здоровьесберегающие технологии (физкультминутки, цветотерапия), развивающее обучение (приемы, направленные на развитие воображения, памяти, речевых навыков, мышления).
У каждого ученика свое видение ситуации, свой язык. Поэтому к каждому необходим свой индивидуальный подход. Наиболее сложны и трудоемки деловые и ролевые игры. Проведение подобных игр позволяет достигать следующих целей: научить учащихся выделять главное в содержании учебного материала, излагать его в краткой форме; развивать навыки анализа текста, ассоциативное мышление, самостоятельность суждений, способствовать самоопределению учащихся, развивать коммуникативные способности, расширить кругозор, повторять и обобщать изученный материал. В своей практике я систематически использую игровые формы организации контроля знаний и постоянно замечаю, как это повышает интерес учащихся к изучаемому материалу и предмету в целом, как учащиеся, которые в последнее время так мало читают, вдруг начинают листать книги, справочники, энциклопедии. Так на уроках, при изучении тем, связанных с экологией, например по теме “Природные источники углеводородов и их переработка”, применяю ролевые игры с применением экспертных групп. Класс разбивается на две группы: “специалистов” и “журналистов”. Первые подбирают материал и подготавливают наглядное пособие. Вторые готовят вопросы, которые они должны задавать во время игры.
Для закрепления материалов в 8 – 9 классах использую дидактические игры: “Химические кубики”, “Химическое лото”, “Крестики-нолики”, “Найди ошибку”, “Химический бой”. Так же на внеклассных занятиях провожу зрелищные интеллектуально-творческие игры: “КВН”, “Что, где, когда”, “Звездный час”.
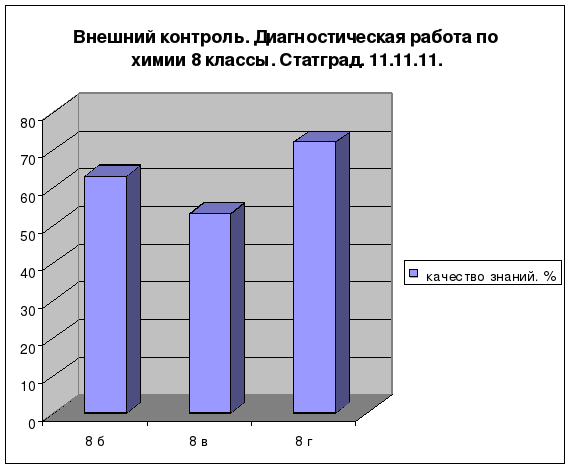
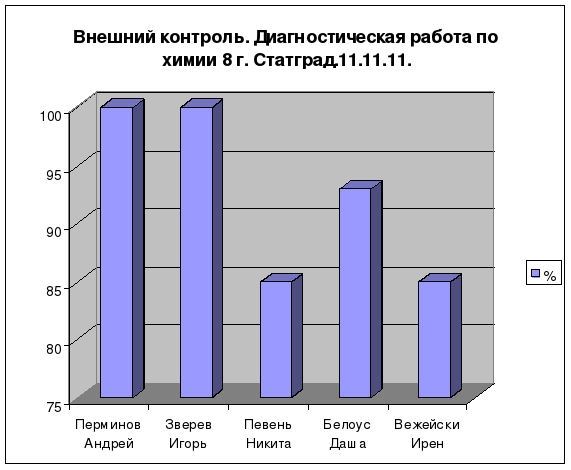
Результаты
Положительная динамика:
качества знаний по химии при 100%-ной обученности за последние 3 года;
количества (%) учащихся, повысивших итоговую оценку за последние 3 года;
количества (%) учащихся, подтвердивших (повысивших) годовую оценку по химии в ходе годовой и итоговой аттестации за последние 3 года;
2.Технологии интенсификации обучения на основе схемных и знаковых моделей учебного материала (В.Ф.Шаталов)
Одной из ответственных задач, стоящих перед учителем, является повышение эффективности всех применяемых в школе форм и методов обучения.
Правильный подход к совершенствованию методов и средств обучения следует строить на научной основе, рассматривая обучение, как целенаправленный организованный процесс взаимодействия, сотрудничества учителя и учащихся, призванный их научным мировоззрением, знаниями и умениями. Педагогической психологией выведен основной закон усвоения: воспринять – осмыслить – запомнить – применить – проверить результат. Из этой формулы ничего нельзя исключить и нецелеобразно разрывать этапы усвоения во времени, потому что они взаимосвязаны: восприятие сопровождается осмысливанием, осмысливание – запоминанием, восприятие, осмысливание и запоминание расширяются, углубляются и закрепляются в процессе их самостоятельного применения и проверки на практике.
По данным психологов К.К. Платонова и Г.Р. Голубева «от услышанного учащимися в течение урока у них в памяти остается в среднем 10% содержания. От воспринятого через чтение закрепляется 30%. Наблюдение учащимися какого-либо предмета или явления оставляет в их памяти в среднем около 50% воспринятого. Практические действия учащихся с учебным материалом составляют в их памяти в среднем 90% воспринятого».
Причиной низкого качества знаний учащихся в школах является главным образом нарушение объективного закона усвоения знаний, когда на уроке деятельность учащихся сводится лишь к восприятию излагаемых учителем готовых знаний и не остаётся времени на осмысление, запоминание, применение и проверку результатов. Все названые выше этапы усвоения знаний, умений должны выполняться лично каждым школьником, его умственным трудом, хотя и под руководством учителя.
1.Опорные сигналы.
Познавательная активность школьника – качество не врожденное и не постоянное, она динамически развивается, может прогрессировать и реагировать под воздействием школы, товарищей, семьи, труда и других социальных факторов. На уровень активности сильно влияют отношения учителя и детей, стиль его общения с учащимся на уроке, успеваемость и настроение самого школьника (успехи в учебе и положительные эмоции повышают познавательную активность). Поэтому у одного и того же ученика на различных уроках познавательная активность резко меняется, в зависимости от того, какой учитель учит, чему учит и как учит, как он умеет активизировать класс. Подлинное сотрудничество учителя и учащихся обеспечивает на уроке активную учебную деятельность класса. Например, работая с опорными сигналами, учащиеся с желанием и старательно сами воспринимают, осмысливают, запоминают, применяют знания и контролируют усвоение. Донецкий учитель- новатор В.Ф.Шаталов, много лет применявший в преподавании астрономии, физики и математики разработанный им метод опорных сигналов, доказывает, что такое обучение эффективнее традиционного. Что такое опорный сигнал, опорный конспект и опорный плакат? Эти понятия ввёл в педагогику Шаталов. Опорный сигнал – это графический символ, замещающий смысл какой-то информации, одной или нескольких фраз в тексте учебника. Сигнал может быть в форме цифры, рисунка, схемы, стрелки или других знаков. Например, химические формулы СО2, Н2О или математические формулы – это тоже опорные сигналы; сигнал ДЦ означает «дыхательный центр», ДНК – «дезоксирибонуклеиновая кислота» и т.д. В жизни каждый человек очень часто пользуется опорными сигналами (сокращенные, зашифрованные записи в блокноте, топографические и дорожные знаки).
В учебной работе опорные сигналы выполняют несколько функций:
А) служат наглядным пособием при объяснении учителя;
Б) упрощают и ускоряют процесс подготовки учащихся к уроку;
В) позволяют увеличить объем изучаемого материала на уроке;
Г) полностью снимают проблему накопляемости отметок;
Д) развивают творческое мышление и познавательность.
Как составлять опорные конспекты?
1. Детально изучить по программе содержание материала, по которому будет составляться опорный конспект для конкретного урока. Выписать основные термины, причинно – следственные связи, имена учёных, их вклад в науку, открытия.
2. Соотнести требования программы с содержанием учебника (на одном уроке может изучаться материал одного или нескольких параграфов).
3. Хорошо знать материал текста и иллюстрации учебника.
4. Разбить данный материал на логически завершенные смысловые блоки (части).
5. Выделить основные термины в каждом блоке.
6. Составить черновой вариант опорных сигналов в каждом блоке, несколько раз откорректировать его в соответствии.
7. Оформить смысловые блоки и опорные сигналы в них в окончательном варианте, в цвете.
2.Использование алгоритмов
В процессе обучения химии приходится выстраивать действия учащихся в соответствии с определенной логикой. Так возникает необходимость использования в практике обучения технологии алгоритмированного обучения. Однако алгоритм – это не только предписание последовательных действий. Алгоритмы сопровождают человека в форме различных правил и инструкций повсюду. Правила дорожного движения, кулинарный рецепт, инструкция по использованию приборов – все это алгоритмы. Не может обойтись без алгоритмов и химия. Алгоритмы в школьном курсе химии – это:
правила составления химических формул и уравнений;
правила и последовательность описания химических элементов, свойств веществ, протекание химических реакций;
рациональный способ решения расчетных, экспериментальных и расчетно-экспериментальных задач;
оптимальный план проведения химического анализа неорганических и органических веществ;
определенный порядок приготовления растворов заданной концентрации
Одно из основных свойств алгоритма – массовость. Это свойство характеризует возможность с помощью алгоритма решать задачи определенного типа, а не только одну конкретную задачу. Есть алгоритмы для каждого типа задач.
Следующим важным свойством алгоритма является дискретность. Это свойство обуславливает пошаговый (дискретный) характер алгоритма. Преобразование исходных данных в конечный результат осуществляется дискретно, т.е. действия или команды в каждый последующий момент времени выполняются по четким правилам вслед за действиями, имевшими место в предыдущий момент времени. Только выполнив одно указание, можно перейти к выполнению следующего.
Основным свойством алгоритма является детерминированность (однозначная определенность) – ориентированность на определенного исполнителя. Это свойство требует, чтобы каждое указание алгоритма было понятно исполнителю, не вызывало неоднозначного его понимания и неопределенного исполнения. Алгоритм, реализованный любым лицом (или машиной), должен вести при одинаковых исходных данных к одинаковым результатам. Одно из важнейших свойств алгоритма – результативность. Последовательное выполнение всех предписываемых действий должно привести к решению задачи за конкретное число шагов (конечное), поскольку алгоритм всегда имеет целью получение искомого результата.
Перечисленные выше важнейшие свойства алгоритма позволяют сформулировать следующее определение: алгоритм – конечная последовательность точно сформулированных правил решения некоторых типов задач. Алгоритмические предписания также широко используются в обучении химии. С целью успешного формирования у учащихся навыков владения химическим языком В.Я. Вивюрский разработал алгоритмические предписания (программы последовательных действий) для составления химических формул при изучении неорганической и органической химии . При разработке алгоритма необходимо формировать процесс решения аналогичных задач: составления формул любых веществ с тем чтобы, свести его к применению в конечной последовательности простых и точных правил:
а) Составление химических формул по валентности и степени окисления.
Данный алгоритм, прежде всего, наиболее часто используется при обучении учащихся символам химических элементов. Для того чтобы усвоить алгоритмы составления уравнений химических реакций, необходимо прочное усвоение химических символов, алгоритмов составления химических формул неорганических и органических веществ, глубокое понимание теоретических вопросов, стехиометрических законов (например, закона сохранения массы веществ, закона Авогадро), сформированность многих умений, в частности, самостоятельной работы и самоконтроля.
б) При решении расчетных задач используют линейные по структуре алгоритмы.
Пример общего алгоритма решения расчетных задач по химии.
Прочитайте текст расчетной химической задачи.
Запишите кратко условия и требования задачи с помощью общепринятых условных обозначений.
Составьте химические формулы, уравнения реакций в соответствии с содержанием расчётной химической задачи и её требованием.
Составьте рациональный план решения задачи.
Продумайте, какие дополнительные данные можно извлечь из химических формул, уравнений реакций для реализации требований задачи.
Произведите все необходимые в данной задаче действия с заданной математической точностью.
Запишите полученный ответ.
Для безошибочного выполнения действия учащиеся должны усвоить систему ориентиров и указаний, представленную в форме алгоритма. Такие алгоритмы можно предложить учащимся при формировании основных приемов логического мышления. Работа проводится по одному и тому же плану:
1) формирование знаний о приеме (разъяснение его смысла; показ образца действий);
2) формирование умений пользоваться приемом по аналогии и в исходных условиях;
3) развитие умений пользоваться приемом самостоятельно и в различных связях.
Отработка приемов умственных действий осуществляется на конкретных химических примерах. Так, задача сравнения возникает каждый раз, когда вводятся новые объекты изучения: химические элементы, вещества, реакции и т.д. В сравнении есть формализованное ядро, каждый раз наполняемое новым содержанием, это ядро можно представить алгоритмом:
Алгоритм сравнения:
Определить цель сравнения объектов.
Выделить признаки, по которым нужно произвести сравнение.
Найти сходство или различие между сравниваемыми объектами.
Сделать вывод.
Алгоритм классификации:
Определить цель классификации.
Выделить существенные признаки объектов.
Сравнить признаки различных объектов.
Выбрать основания для классификации.
Разделить объекты по выбранному основанию
Учащимися предлагаем задания на сравнение строения атомов элементов №8 и №16; №11 и №13; №11 и №17. Примеры подобраны таким образом, что учащиеся смогут не только провести сравнение строения атомов элементов, но и попытаться сделать вывод о закономерностях изменения свойств атомов элементов по группе и периоду.
Вывод: Систематическая работа с опорными сигналами повышает интерес к предмету, учебную активность учащихся, обеспечивает глубокое и прочное усвоение знаний, развивает мышление, память и речь учащихся, способствуют воспитанию честности, прилежного и добросовестного отношения к учебному труду. Применение алгоритмов позволяет совершать действия, активизирует преимущественно репродуктивную деятельность учащихся. Важная особенность обучения - создание условий для продуктивной деятельности по использованию знаний, их обобщению и систематизации. Подобная организация учебного процесса развивает мыслительные способности учащихся, заставляет их быть внимательными, учит анализировать, сравнивать, выделять главное, превращает из пассивных слушателей на уроке в активных участников.
Вывод: Таким образом различные виды технологий способствуют развитию познавательных и творческих интересов у учащихся.
 Получите свидетельство
Получите свидетельство Вход
Вход












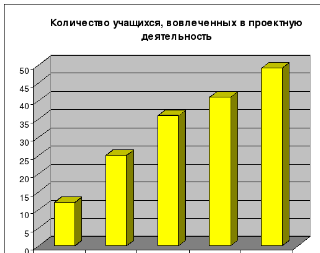 ктивное участие учащихся в проектно-исследовательской деятельности: наблюдается положительная динамика количества учащихся 7-11-ых классов, вовлеченных в проектную деятельность:
ктивное участие учащихся в проектно-исследовательской деятельности: наблюдается положительная динамика количества учащихся 7-11-ых классов, вовлеченных в проектную деятельность: 










 Подготовка к ЕГЭ по химии (0.99 MB)
Подготовка к ЕГЭ по химии (0.99 MB)
 0
0 2190
2190 309
309 Нравится
0
Нравится
0


