
Газовые законы

«Посев научный взойдет для жатвы народной!»
(Дмитрий Иванович Менделеев)

план
- Уравнение состояния идеального газа. (Клапейрона)
- Уравнение Менделеева - Клапейрона
- Понятие « ИЗО ПРОЦЕССЫ»
4. Виды изопроцессов
5. Газовые законы
6. Графическое представление газовых законов

Вопросы:
Как называется модель на которой рассматривают состояние газообразных тел
( идеальный газ )
Какими параметрами характеризуется состояние идеального газа
( давление, объём, температура )

- Как называются эти параметры
( макроскопические )
- Как термодинамический параметр давление связан с микроскопическими параметрами?
( основное уравнение МКТ )
- Как объём связан с микроскопическими параметрами?
( объём обратно пропорционален
концентрации )

- Температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа . Выведем уравнение, устанавливающее зависимость между этими параметрами.


Клапейрон Бенуа Поль Эмиль
- (26.I.1799–28.I.1864)
- Французский физик, член Парижской АН (1858). Окончил Политехническую школу в Париже (1818). В 1820–30 работал в Петербурге в институте инженеров путей сообщения.


Менделеев Дмитрий Иванович
- (8.II.1834–2.II.1907)
- Русский ученый-энциклопедист.. В 1874 вывел общее уравнение состояния идеального газа, обобщив уравнение Клапейрона(уравнение Клапейрона-Менделеева).

Уравнение состояния - первое из замечательных обобщений в физике, с помощью которых свойства разных веществ выражаются через одни и те же основные величины. Именно к этому стремиться физика - к нахождению общих законов, не зависящих от тех или иных веществ. Газы, существенно простые по своей природе, дали первый пример такого обобщения.

Процесс изменения состояния идеального газа при неизменном значении одного из макроскопических параметров - изопроцесс

И ЗО ТЕРМИЧЕСКИЙ ПРОЦЕСС T = const
Процесс изменения состояния идеального газа при постоянной температуре
m=const р V = const
T = const закон
Бойля -
Мариотта

К этому выводу пришёл английский учёный Роберт Бойль в 1662 г. и французский физик Э.Мариотт в 1676г.

Закон Бойля -Мариотта
Для газа данной массы произведение давления газа на его объём постоянно, если температура газа не меняется
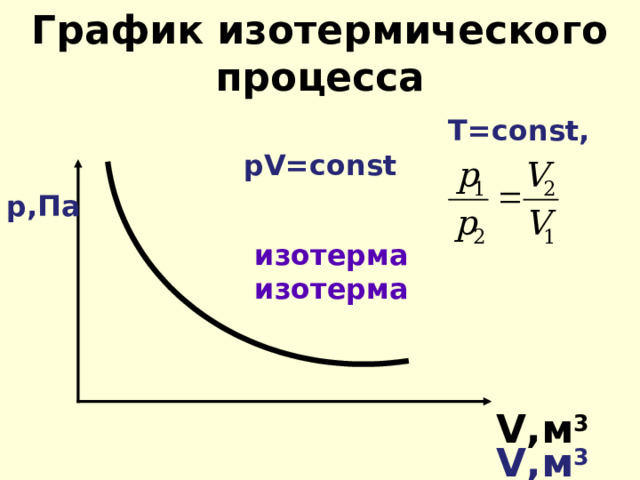
График изотермического процесса
Т= const, р V = const
р,Па
изотерма
изотерма
V ,м 3
V ,м 3
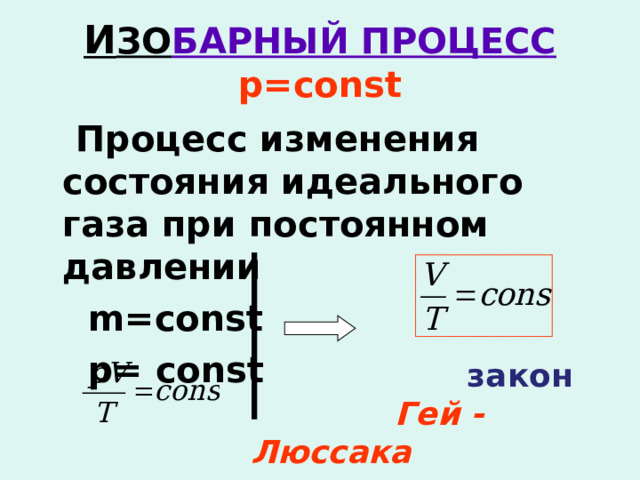
И ЗО БАРНЫЙ ПРОЦЕСС р =const
Процесс изменения состояния идеального газа при постоянном давлении
m=const
р = const
закон
Гей - Люссака

Этот закон экспериментально был открыт в 1802г. Французским учёным Гей-Люссаком

Закон Гей-Люссака
Для газа данной массы отношение объёма к температуре постоянно, если давление не меняется.
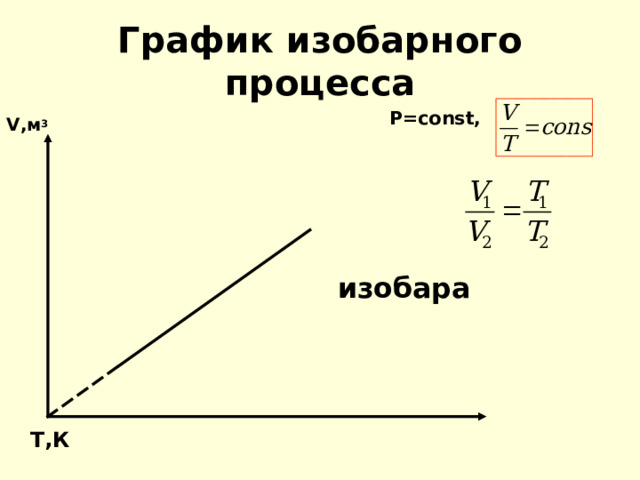
График изобарного процесса
V ,м 3 P=const,
изобара
T ,К
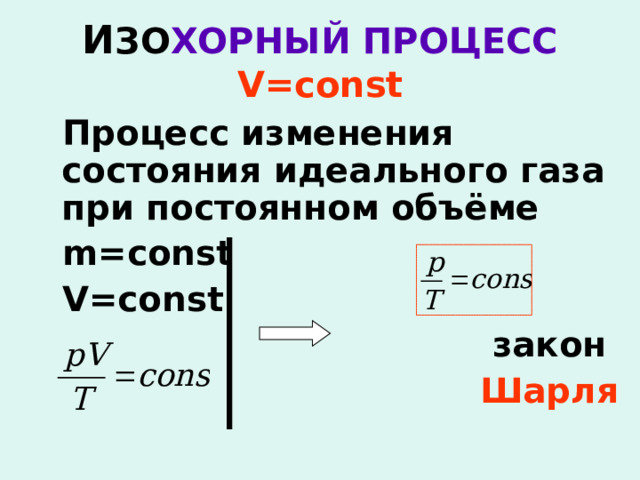
И ЗО ХОРНЫЙ ПРОЦЕСС V=const
Процесс изменения состояния идеального газа при постоянном объёме
m=const
V=const
закон
Шарля

Эту зависимость экспериментально установил в 1787г. французский физик Шарль

Закон Шарля
Для данной массы газа отношение давления к температуре постоянно, если объём не меняется
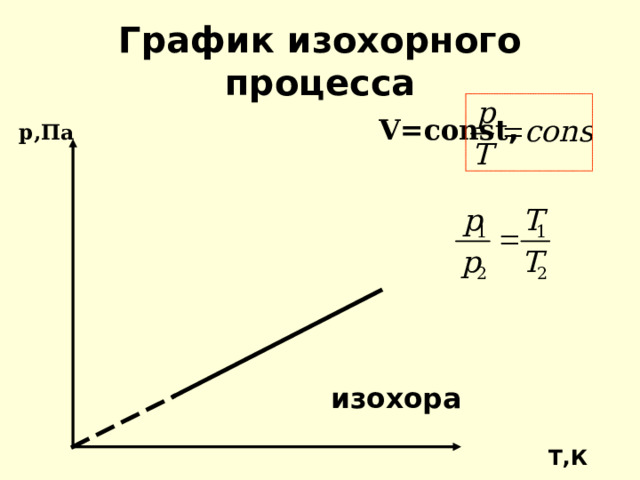
График изохорного процесса
р,Па V=const ,
изохора
Т,К

Эти законы справедливы для любых газов, а так же для смесей газов(например воздуха)

Задачи:
1. Почему баллон с любым сжатым газом представляет большую опасность при пожаре?
2. В двух сосудах одинакового объема при одинаковых температуре и давлении находится водород и азот. Масса какого из газов больше и во сколько раз?
3. Иногда из бутылки, наполненной газированной водой, вылетает пробка, если бутылка поставлена в теплое место. Почему?

Задачи:
4. Какой объём будет занимать газ при температуре 77 ◦ С, если при 27 ◦ С его объём равен 0,006 м 3 ,при постоянном давлении.

V 1 - ? «СИ»
t 1 =77 ◦ С Т 1 =77+273=350К
t 2 =27 ◦ С Т 2 = 300К
V 2 =0,006 м 3
Ответ: 0,007 м 3 .
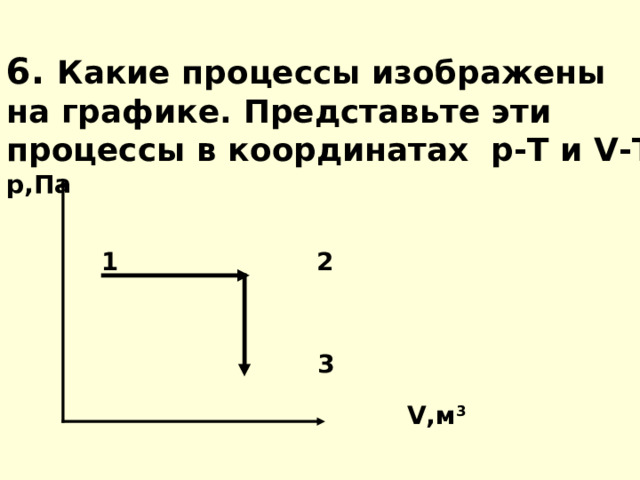
6. Какие процессы изображены на графике. Представьте эти процессы в координатах р-Т и V - T р,Па 1 2 3 V ,м 3
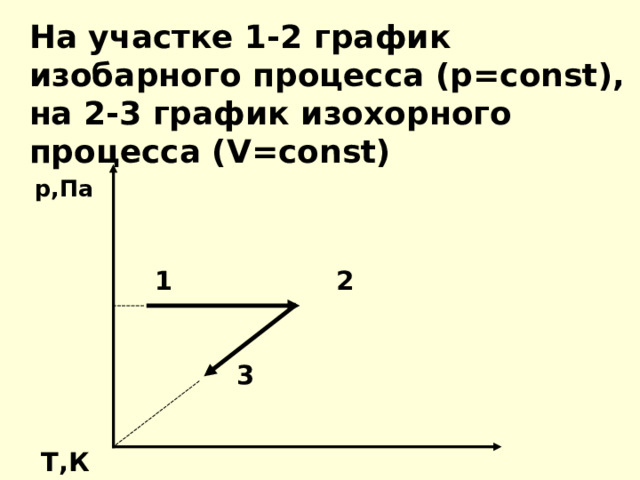
На участке 1-2 график изобарного процесса (р= const ), на 2-3 график изохорного процесса ( V = const)
р,Па
1 2
3
Т,К
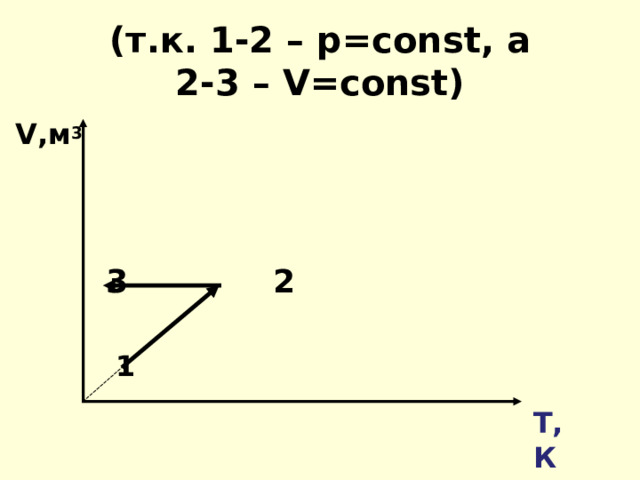
( т.к. 1-2 – р= const , а 2-3 – V = const)
V ,м 3
3 2
1
T ,К

Домашнее задание:
§70, 71; упражнение 13(2,3,11) – 2005
§68, 69 ; упражнение 13(1,2,8) - 2008

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация к уроку " Уравнение состояния идеального газа. Газовые законы" (2.79 MB)
Презентация к уроку " Уравнение состояния идеального газа. Газовые законы" (2.79 MB)
 0
0 657
657 71
71 Нравится
0
Нравится
0


