«Рассмотрено» «Согласовано» «Утверждено»
Руководитель НМС заместитель директора по УВР директор
________/ Мартышкина И.В / МБОУ «Лицей №4» МБОУ «Лицей №4»
Протокол №____ от __________/_Старостина Н.Н. ___________/Дуденкова Т.В.
«_____» августа 2013г. «_____» августа 20__г приказ № ___
от «___» августа 2013г
РАБОЧАЯ ПРОГРАММА
ХИМИЯ
Основная ступень, базовый уровень
Баймашкина Татьяна Александровна, высшая квалификационная категория
Муниципальное бюджетное общеобразовательное учреждение
«Лицей №4»
Рузаевского муниципального района Республики Мордовия
Класс: 10 КЛАСС
на 2013-2014 учебный год
Составлена на основе: Рабочая программа составлена на основе Примерной программы основного общего образования по химии,
Москва, Просвещение, 2010
Учебник: Г.Е. Рудзитис, Ф.Г. Фельдман «Химия -10»
ПРОГРАММА
СРЕДНЕГО (ПОЛНОГО) ОБЩЕГО ОБРАЗОВАНИЯ
ПО ХИМИИ (БАЗОВЫЙ УРОВЕНЬ)
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Статус документа
Программа по химии составлена на основе федерального компонента государственного стандарта среднего (полного) общего образования.
Программа конкретизирует содержание предметных тем образовательного стандарта, дает примерное распределение учебных часов по разделам курса и рекомендуемую последовательность изучения тем и разделов учебного предмета с учетом межпредметных и внутрипредметных связей, логики учебного процесса, возрастных особенностей учащихся. В программе определен перечень демонстраций, лабораторных опытов, практических занятий и расчетных задач.
Программа выполняет две основные функции:
Информационно-методическая функция позволяет всем участникам образовательного процесса получить представление о целях, содержании, общей стратегии обучения, воспитания и развития учащихся средствами данного учебного предмета.
Организационно-планирующая функция предусматривает выделение этапов обучения, структурирование учебного материала, определение его количественных и качественных характеристик на каждом из этапов, в том числе для содержательного наполнения промежуточной аттестации учащихся.
Программа является ориентиром для составления авторских учебных программ и учебников. Программа определяет инвариантную (обязательную) часть учебного курса химии в старшей школе на базовом уровне, за пределами которого остается возможность авторского выбора вариативной составляющей содержания образования. Составители учебных программ и учебников химии могут предложить собственный подход в части структурирования и определения последовательности изучения учебного материала, а также путей формирования системы знаний, умений и способов деятельности, развития и социализации учащихся. Тем самым программа содействует сохранению единого образовательного пространства и предоставляет широкие возможности для реализации различных подходов к построению курса химии в старшей школе на базовом уровне.
Общая характеристика учебного предмета
Основными проблемами химии являются изучение состава и строения веществ, зависимости их свойств от строения, конструирование веществ с заданными свойствами, исследование закономерностей химических превращений и путей управления ими в целях получения веществ, материалов, энергии. Поэтому, как бы ни различались авторские программы и учебники по глубине трактовки изучаемых вопросов, их учебное содержание должно базироваться на содержании программы, которое структурировано по пяти блокам: введение в органическую химию; углеводороды; кислородсодержащие органические вещества; азотсодержащие органические веществыа; высокомолекулярные синтетические вещества. Содержание этих учебных блоков в авторских программах может структурироваться по темам и детализироваться с учетом авторских концепций, но должно быть направлено на достижение целей химического образования в старшей школе.
Цели
Изучение химии в старшей школе на базовом уровне направлено на достижение следующих целей:
Изучение химии в старшей школе на базовом уровне направлено на достижение следующих целей:
- освоение знаний о химической составляющей естественнонаучной картины мира, важнейших химических понятий, законах и теориях;
- овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов;
- развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
- воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и к окружающей среде;
- применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Задачи изучения химии.
Формирование у учащихся знания основ химической науки: важнейших факторов, понятий, химических законов и теорий, языка науки, доступных обобщений мировоззренческого характера.
Развитие умений наблюдать и объяснять химические явления, происходящие в природе, лаборатории, в повседневной жизни.
Формирование специальных умений: обращаться с веществами, выполнять несложные эксперименты, соблюдая правила техники безопасности; грамотно применять химические знания в общении с природой и в повседневной жизни.
Раскрытие гуманистической направленности химии, ее возрастающей роли в решении главных проблем, стоящих перед человечеством, и вклада в научную картину мира.
Развитие личности обучающихся: их интеллектуальное и нравственное совершенствование, формирование у них гуманистических отношений и экологически целесообразного поведения в быту и в процессе трудовой деятельности.
Место предмета в базисном учебном плане
Федеральный базисный учебный план для образовательных учреждений Российской Федерации отводит 70 часов для обязательного изучения учебного предмета «Химия» на этапе среднего (полного) общего образования на базовом уровне.
Программа рассчитана на 70 учебных часов. Данная рабочая программа составлена на основе программы общеобразовательных учреждений по химии для 8-11 классов и скорректирована на основе многолетнего опыта работы учителя, поэтому внесены некоторые изменения:
В рабочую программу добавлена лабораторная работа « изготовление моделей молекул непредельных углеводородов и галогенпроизводных». Учебник предлагает лабораторную работу «взаимодействие фенола с бромной водой и раствором гидроксида натрия», а программа предусматривает эту работу в виде демонстрационного опыта.
В курсе 10 класса закладываются основы знаний по органической химии: теория строения органических соединений А.М. Бутлерова, понятия «гомология», «изомерия» на примере углеводородов, кислородсодержащих и других органических соединений, рассматриваются причины многообразия органических веществ, особенности их строения и свойств, прослеживается причинно-следственная зависимость между составом, строением, свойствами и применением различных классов органических веществ, генетическая связь между различными классами органических соединений, а также между органическими и неорганическими веществами. В конце курса даются некоторые сведения о прикладном значении органической химии.
Объектами особого внимания являются факты взаимного влияния атомов в молекуле и вопросы, касающиеся механизмов химических реакций.
В основу программы положен принцип развивающего обучения. Программа опирается на материал, изученный в 8–9 классах, поэтому некоторые темы курса рассматриваются повторно, но уже на более высоком теоретическом уровне. Такой подход позволяет углублять и развивать понятие о веществе и химическом процессе, закреплять пройденный материал в активной памяти учащихся, а также сохранять преемственность в процессе обучения.
Программа обеспечивает сознательное усвоение учащимися важнейших химических законов, теорий и понятий; формирует представление о роли химии в развитии разнообразных отраслей производства; знакомит с веществами, окружающими человека. При этом основное внимание уделяется сущности химических реакций и методам их осуществления, а также способам защиты окружающей среды.
Программа составлена с учетом ведущей роли химического эксперимента. Предусматриваются все виды школьного химического эксперимента — демонстрации, лабораторные опыты и практические работы. Рабочая программа по химии реализуется через формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций за счёт использования технологий коллективного обучения, опорных конспектов, дидактических материалов, и применения технологии графического представления информации при структурировании знаний.
В целом курс позволяет развить представления учащихся о познаваемости мира, единстве живой и неживой природы, сформировать знания о важнейших аспектах современной естественно научной картины мира, умения, востребованные в повседневной жизни и позволяющие ориентироваться в окружающем мире, воспитать человека, осознающего себя частью природы.
Требования к уровню подготовки обучающихся
на ступени среднего (полного) общего образования
знать
- важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
- основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
- основные теории химии: химической связи, электролитической диссоциации, строения органических соединений;
- важнейшие вещества и материалы: основные металлы и сплавы; серная, соляная, азотная и уксусная кислоты; щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы;
уметь:
- называть изученные вещества по "тривиальной" или международной номенклатуре;
- определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений;
- характеризовать: элементы малых периодов по их положению в периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединений;
- объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов:
- выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ;
- проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- объяснения химических явлений, происходящих в природе, быту и на производстве;
- определения возможности протекания химических превращений в различных условиях и оценки их последствий;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
- безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
- приготовления растворов заданной концентрации в быту и на производстве;
- критической оценки достоверности химической информации, поступающей из разных источников
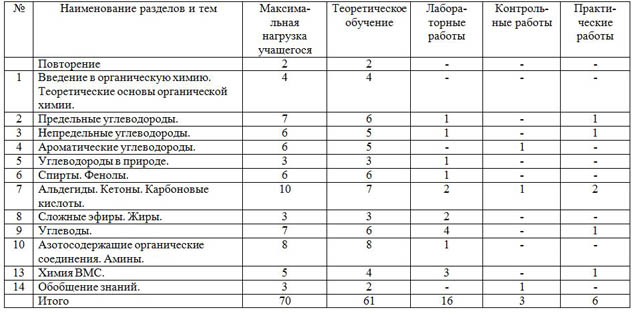
Тематическое планирование по дисциплине_____Химия
| № | Наименование разделов и тем | Максима- льная нагрузка учащегося | Теоретическое обучение | Лабора- торные работы
| Контроль- ные работы
| Практи- ческие работы |
|
| Повторение | 2 | 2 | - | - | - |
| 1 | Введение в органическую химию. Теоретические основы органической химии. | 4 | 4 | - | - | - |
| 2 | Предельные углеводороды. | 7 | 6 | 1 | - | 1 |
| 3 | Непредельные углеводороды. | 6 | 5 | 1 | - | 1 |
| 4 | Ароматические углеводороды. | 6 | 5 | - | 1 | - |
| 5 | Углеводороды в природе. | 3 | 3 | 1 | - | - |
| 6 | Спирты. Фенолы. | 6 | 6 | 1 | - | - |
| 7 | Альдегиды. Кетоны. Карбоновые кислоты. | 10 | 7 | 2 | 1 | 2 |
| 8 | Сложные эфиры. Жиры. | 3 | 3 | 2 | - | - |
| 9 | Углеводы. | 7 | 6 | 4 | - | 1 |
| 10 | Азотосодержащие органические соединения. Амины. | 8 | 8 | 1 | - | - |
| 13 | Химия ВМС. | 5 | 4 | 3 | - | 1 |
| 14 | Обобщение знаний. | 3 | 2 | - | 1 | - |
|
| Итого | 70 | 61 | 16 | 3 | 6 |
ОСНОВНОЕ СОДЕРЖАНИЕ ( 70ч.)
Повторение основных вопросов курса: «Неорганическая химия». (2 часа)
ПСХЭ Д.И. Менделеева. Химическая связь. Свойства неорганических веществ. Классификация неорганических веществ.
Тема 1. Теория химического строения органических соединений. Электронная природа химических связей - 4часа.
Предмет органической химии. Взаимосвязь неорганических и органических веществ. Особенности органических соединений и реакций с их участием.
Основные положения теории химического строения органических соединений А. М. Бутлерова. Химическое строение как порядок соединения атомов в молекулах. Зависимость свойств веществ от химического строения молекул. Изомерия. Значение теории химического строения.
Электронная природа химических связей в органических соединениях.
Классификация органических соединений.
Демонстрации
1. Образцы органических веществ, изделия из них.
2. Шаростержневые модели молекул.
В результате изучения темы учащиеся должны
Знать
важнейшие химические понятия: органическая химия, органические вещества, валентность, структурная формула, химическое строение, изомерия, изомеры; ациклические, циклические (карбоциклические), алициклические, ароматические, гетероциклические, предельные УВ, непредельные УВ, функциональная группа (ФГ), виды ФГ;
основные законы химии: основные положения теории химического строения органических веществ А.М.Бутлерова;
иметь представление о значении теории химического строения органических веществ;
виды электронных орбиталей, типы взаимодействия между ними: σ-связь, π-связь, сущность понятий: обменный и донорно-акцепторный механизм образования ковалентной связи; типы разрыва ковалентной связи: гомо- и гетеролитический, свободные радикалы;
классификацию ОВ по строению углеродного скелета и по кратности связей, по функциональным группам;
алгоритм решения задачи на установление химической формулы вещества: а) по известному элементному составу, б) по продуктам его сгорания.
Уметь
характеризовать значение и роль органической химии в современном обществе, историю возникновения и развития органической химии;
определять изомеры по структурным формулам, валентность химических элементов; записывать молекулярные и структурные формулы органических веществ;
характеризовать механизм образования и разрыва ковалентной связи.
классифицировать органические вещества по строению углеродного скелета и по кратности связей, по функциональным группам;
производить расчеты по установлению хим. формулы органического соединения.
Тема 2. Предельные углеводороды (алканы, или парафины) - 7часов.
Алканы. Электронное и пространственное строение молекулы метана, sp3-гибридизация орбиталей атома углерода. Гомологический ряд, номенклатура и изомерия углеродного скелета. Физические свойства алканов и их зависимость от молекулярной массы. Химические свойства: галогенирование (на примере метана и этана), горение, термические превращения (разложение, крекинг, дегидрирование, изомеризация). Конверсия метана. Нахождение в природе и применение алканов.
Циклоалканы. Строение, номенклатура и изомерия. Нахождение в природе. Получение. Физические и химические свойства. Применение.
Демонстрации
1. Примеры углеводородов в разных агрегатных состояниях (пропан-бутановая смесь в зажигалке, бензин, парафин, асфальт)
2. Схема образования ковалентной связи в неорганических и органических соединениях.
3. Шаростержневые и масштабные модели молекул метана и других углеводородов.
4. Определение наличия углерода и водорода в составе парафина по продуктам горения.
5. Видеоопыты: Горение метана, парафина в условиях избытка и недостатка кислорода. Взрыв смеси метана с воздухом. Отношение метана к бромной воде.
Лабораторные опыты
№1. Изготовление моделей молекул углеводородов и галогенопроизводных.
Практическая работа
№1.Качественное определение углерода, водорода и хлора в органических веществах.
В результате изучения темы учащиеся должны
Знать
определение понятия «алканы», их общую формулу, электронную конфигурацию атома углерода в основном и возбужденном состоянии, строение молекулы метана (sp3-гибридизация, валентный угол, тетраэдрическая молекула);
определение понятий «гомологи», «гомологический ряд», «гомологическая разность», гомологический ряд ПУВ, изомерию (структурная изомерия углеродного скелета), номенклатуру ПУВ;
нахождение в природе, получение и применение алканов, физические свойства и основные типы реакций, характерные для алканов;
определение понятия «циклоалканы», их общую формулу, гомологический ряд, изомерию, номенклатуру, нахождение в природе, физ. и хим. свойства, получение и применение.
Уметь
находить алканы среди других ОВ на основании общей формулы;
характеризовать строение молекулы метана;
записывать молекулярные и структурные формулы ПУВ и их изомеров, давать им названия;
определять типы реакций, характерных для алканов, записывать схемы реакций;
записывать молекулярные и структурные формулы циклоалканов и их изомеров, давать им названия, записывать схемы реакций;
решать задачи на установление химической формулы вещества: а) по известной общей формуле и массовой доле одного из элементов, б) по его реакционной способности; выполнять химический эксперимент, соблюдая правила ТБ.
Тема 3. Непредельные углеводороды (алкены, алкадиены и алкины) - 6 часов.
Электронное и пространственное строение молекулы этилена, sp2-гибридизация орбиталей атома углерода. σ-Связи и π-связи. Гомологический ряд, номенклатура. Структурная изомерия (изомерия углеродного скелета и положения двойной связи в молекуле). Закономерности изменения физических свойств алкенов. Химические свойства (на примере этилена): реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), окисления (горение) и полимеризации.
Промышленные и лабораторные методы получения алкенов: дегидрирование и термический крекинг алканов и дегидратация спиртов.
Алкадиены. Понятие о диеновых углеводородах. Бутадиен1,3 (дивинил) и 2-метилбутадиен-1,3 (изопрен). Получение и химические свойства: реакции присоединения и полимеризации. Натуральный и синтетические каучуки. Вулканизация каучука. Резина. Применение каучука и резины. Работы С. В. Лебедева.
Алкины. Электронное и пространственное строение молекулы ацетилена. sp-Гибридизация орбиталей атома углерода. Гомологический ряд, изомерия и номенклатура алкинов. Физические и химические свойства (на примере ацетилена). Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), окисления (горение). Получение ацетилена карбидным и метановым способами, его применение.
Демонстрации
1. Шаростержневая и масштабная модели молекулы этилена.
2. Видеоопыты. Получение этилена и его свойства: горение, взаимодействие с бромной водой.
3. Отношение каучука и резины к органическим растворителям.
4. Разложение каучука при нагревании и испытание на непредельность продуктов разложения.
5. Шаростержневая и масштабная модели молекулы ацетилена.
6. Видеоопыты. Получение ацетилена карбидным способом и его свойства: горение, взаимодействие с бромной водой.
Практическая работа
№2.Получение этилена и опыты с ним.
В результате изучения темы учащиеся должны
Знать
определение «алкены», их общую формулу, строение молекул, номенклатуру, изомерию, способы получения, правило Зайцева;
физические и химические свойства алкенов: реакции присоединения, окисления, полимеризации; определения понятий: реакция гидрирования, гидратации, галогенирования, гидрогалогенирования, полимеризации, мономер, полимер, структурное звено, степень полимеризации; правило Марковникова; качественные реакции на алкены, применение алкенов;
физические и химические свойства алкенов: реакции присоединения, окисления, полимеризации; определения понятий: реакция гидрирования, гидратации, галогенирования, гидрогалогенирования, полимеризации, мономер, полимер, структурное звено, степень полимеризации; правило Марковникова; качественные реакции на алкены, применение алкенов;
химические свойства алкадиенов, применение алкадиенов; определение понятия «каучуки» и их представителей;
определение «алкадиены», общую формулу, строение молекул, классификацию, изомерию, номенклатуру, физические свойства, получение алкадиенов;
определение «алкины», общую формулу, строение молекул, изомерию, номенклатуру, физические свойства, способы получения алкинов;
химические свойства алкинов: реакции присоединения (галогенирование, гидрогалогенирование, гидрирование, гидратация (реакция Кучерова), изомеризации, тримеризации ацетилена в бензол, реакции окисления, качественную реакцию на алкины.
Уметь
составлять молекулярные и структурные формулы алкенов и их изомеров и давать им названия, записывать схемы реакций получения;
записывать схемы реакций, отражающих хим. свойства алкенов, определять тип реакции;
записывать структурные формулы изомеров, определять вид изомерии, давать названия соединений по структурным формулам, записывать схемы реакций получения;
записывать схемы реакций, отражающих хим. свойства алкадиенов, характеризовать состав и свойства каучуков;
записывать схемы реакций получения алкинов, определять их тип, записывать структурные формулы изомеров и называть их;
записывать схемы реакций, отражающих хим. свойства алкинов, определять тип реакции;
решать задачи на установление химической формулы вещества: а) по известной общей формуле и массовой доле одного из элементов, б) по его реакционной способности;
выполнять химический эксперимент, соблюдая правила ТБ.
Тема 4. Ароматические углеводороды (арены) – 6 часов.
Состав и строение аренов на примере бензола. Физические свойства бензола, его токсичность. Химические свойства: реакции замещения (нитрование, галогенирование), присоединения (гидрирование, хлорирование), горения. Получение и применение бензола.
Генетическая взаимосвязь углеводородов.
Демонстрации
1. Структурные формулы молекулы бензола.
2. Видеоопыты «Свойства бензола».
В результате изучения темы учащиеся должны
Знать
определение понятий: ароматические УВ, ароматическая связь;
строение молекулы бензола, названия и формулы важнейших гомологов бензола, изомерию, номенклатуру, способы получения;
физические и химические свойства, применение бензола и его гомологов.
Уметь
определять тип хим. реакции, характеризовать строение и свойства вещества;
определять характер взаимного влияния атомов в молекулах, объяснять зависимость реакционной способности органических соединений от строения их молекул;
определять принадлежность веществ к определенному классу органических соединений; записывать схемы хим. реакций, лежащих в основе цепочки превращений.
Тема 5. Природные источники углеводородов и их переработка – 3 часа.
Природный и попутный нефтяной газы, их состав и применение в качестве источника энергии и химического сырья. Нефть, ее состав и свойства. Продукты фракционной перегонки нефти. Крекинг нефтепродуктов. Октановое число бензинов. Охрана окружающей среды при нефтепереработке и транспортировке нефтепродуктов.
Демонстрации
1. Коллекция «Нефть и продукты ее переработки».
2. Коллекция «Каменный уголь и продукты его переработки».
Лабораторные опыты
№2. Ознакомление с образцами продуктов нефтепереработки и коксования каменного угля.
Расчетные задачи
Решение задач на установление химической формулы соединения по известному элементному составу и по продуктам сгорания.
В результате изучения темы учащиеся должны
Знать
природные источники углеводородов, их состав, месторождения, промышленную переработку и продукты переработки.
Уметь
Тема 6. Спирты и фенолы – 6 часов.
Функциональная группа, классификация: одноатомные и многоатомные спирты.
Предельные одноатомные спирты. Номенклатура, изомерия и строение спиртов. Водородная связь между молекулами и ее влияние на физические свойства спиртов. Химические свойства спиртов (на примере метанола и этанола): замещение атома водорода в гидроксильной группе, замещение гидроксильной группы, окисление. Качественная реакция на спирты. Получение и применение спиртов, физиологическое действие на организм человека.
Многоатомные спирты: этиленгликоль и глицерин. Токсичность этиленгликоля. Особенности химических свойств и практическое использование многоатомных спиртов. Качественная реакция.
Фенолы. Получение, физические и химические свойства фенола. Реакции с участием гидроксильной группы и бензольного кольца, качественная реакция на фенол. Его промышленное использование. Действие фенола на живые организмы. Охрана окружающей среды от промышленных отходов, содержащих фенол.
Демонстрации
1.Растворимость спиртов в воде.
2.Химические свойства спиртов: горение, взаимодействие с натрием и дихроматом натрия в кислотной среде.
3.Растворимость фенола в воде при обычной температуре и при нагревании.
4.Вытеснение фенола из фенолята натрия угольной кислотой.
5.Качественная реакция на фенол.
Лабораторные опыты
№3. Растворение глицерина в воде и реакция его с гидроксидом меди (II).
№4.Взаимодействие фенола с бромной водой и раствором гидроксида натрия.
В результате изучения темы учащиеся должны
Знать
определение понятий «спирты», «функциональная группа», «водородная связь», «ароматические спирты», «фенолы»;
общую формулу одноатомных предельных спиртов, строение молекул, изомерию, номенклатуру;
способы получения метанола и этанола, физ. и хим. свойства предельных одноатомных спиртов, применение;
общую формулу, номенклатуру диолов и триолов; физические и химические свойства, применение этиленгликоля и глицерина; качественную реакцию на многоатомные спирты;
физические и химические свойства фенола, качественные реакции на фенол, применение.
Уметь
характеризовать образование водородной связи между молекулами и ее влияние на физические свойства спиртов;
записывать схемы реакций, отражающих хим. свойства и получение предельных одноатомных спиртов;
записывать схемы реакций с участием многоатомных спиртов, характеризовать этиленгликоль и глицерин;
представителей ароматических спиртов и фенолов;
строение молекулы фенола, получение;
записывать молекулярные и структурные формулы фенолов и ароматических спиртов и давать им названия;
объяснять химические свойства фенола с точки зрения взаимного влияния атомов в молекуле, записывать схемы реакций.
Тема 7. Альдегиды, кетоны и карбоновые кислоты – 10 часов.
Состав, общая формула, номенклатура и изомерия. Электронное строение карбонильной группы, особенности двойной связи. Физические и химические свойства (на примере уксусного или муравьиного альдегида): реакции присоединения, окисления, полимеризации. Качественные реакции на альдегиды. Ацетальдегид и формальдегид: получение и применение. Действие альдегидов на живые организмы.
Карбоновые кислоты. Классификация карбоновых кислот: предельные, непредельные; низшие и высшие кислоты. Гомологический ряд предельных одноосновных кислот. Номенклатура, изомерия, строение карбоксильной группы. Физические и химические свойства: взаимодействие с металлами, основаниями, основными и амфотерными оксидами, солями, спиртами; реакции с участием углеводородного радикала.
Особенности строения и свойств муравьиной кислоты. Получение и применение карбоновых кислот.
Сравнение свойств неорганических и органических кислот.
Демонстрации
1.Модели молекул метаналя и этаналя.
2.Взаимодействие формальдегида с аммиачным раствором оксида серебра (реакция серебряного зеркала»).
3.Образцы различных карбоновых кислот.
4.Отношение карбоновых кислот к воде.
5.Качественная реакция на муравьиную кислоту.
Лабораторные опыты
№5. Получение этаналя окислением этанола.
№6.Окисление метаналя (этаналя).
Практическая работа
№3. Получение и свойства карбоновых кислот.
№4. Решение экспериментальных задач на распознавание органических веществ.
В результате изучения темы учащиеся должны
Знать
определение понятий «альдегиды», «кетоны», общие формулы, важнейших представителей, номенклатуру, изомерию, способы получения;
физические и химические свойства альдегидов и кетонов, качественные реакции на альдегиды, применение;
определение понятия «карбоновые кислоты», общую формулу, номенклатуру, классификацию, важнейших представителей, их физические свойства; изомерию, получение предельных одноосновных карбоновых кислот;
химические свойства одноосновных предельных карбоновых кислот;
названия, молекулярные и структурные формулы акриловой, метакриловой, стеариновой, олеиновой, линолевой кислот, их физические и химические свойства, применение.
Уметь
записывать молекулярные и структурные формулы альдегидов и кетонов, их изомеров, давать названия, записывать схемы реакций получения;
характеризовать физические и химические свойства альдегидов и кетонов; записывать схемы реакций;
записывать структурные формулы карбоновых кислот, называть их, характеризовать физические свойства;
записывать схемы реакций получения предельных одноосновных карбоновых кислот;
характеризовать хим. свойства одноосновных предельных карбоновых кислот в свете учения о взаимном влиянии атомов в молекуле;
записывать структурные формулы непредельных карбоновых кислот;
записывать схемы реакций, характеризующих химические свойства и генетическую связь карбоновых кислот с другими классами органических соединений.
проводить хим. эксперимент, соблюдая правила ТБ;
распознавать органические вещества по их физическим и химическим свойствам.
Тема 8. Сложные эфиры. Жиры – 3 часа.
Сложные эфиры. Состав, номенклатура. Реакция этерификации. Гидролиз сложных эфиров. Примеры сложных эфиров, их физические свойства, распространение в природе и применение.
Жиры. Состав и строение. Жиры в природе, их свойства. Гидролиз и гидрирование жиров в промышленности. Превращения жиров в организме. Пищевая ценность жиров и продуктов на их основе.
Мыла — соли высших карбоновых кислот. Состав, получение и свойства мыла. Синтетические моющие средства (CMC), особенности их свойств. Защита природы от загрязнения CMC.
Лабораторные опыты
№7. Растворимость жиров, доказательство их непредельного характера, омыление жиров.
№8.Сравнение свойств мыла и синтетических моющих средств.
В результате изучения темы учащиеся должны
Знать
определение, общую формулу, номенклатуру, изомерию, физические и химические свойства, получение, применение сложных эфиров;
определение понятия «жиры», общую формулу, классификацию, физические и химические свойства (гидрирование, гидратация, щелочной гидролиз);
свойства мыла и СМС.
Уметь
записывать структурные формулы сложных эфиров, называть их, изображать структурные формулы изомеров, характеризовать физические и химические свойства, записывать схемы реакций получения и химических свойств;
характеризовать свойства жиров, мыла и СМС.
Тема 9. Углеводы – 7 часов.
Глюкоза. Строение молекулы (альдегидная форма). Физические и химические свойства глюкозы. Реакции с участием альдегидной и гидроксильных групп, брожение. Природные источники и способы получения глюкозы. Биологическая роль и применение. Фруктоза как изомер глюкозы. Состав, строение, нахождение в природе, биологическая роль.
Сахароза. Состав, физические свойства и нахождение в природе. Химические свойства, получение и применение сахарозы. Биологическое значение.
Крахмал — природный полимер. Состав, физические свойства и нахождение в природе. Химические свойства, получение и применение. Превращения пищевого крахмала в организме. Гликоген, роль в организме человека и животных.
Целлюлоза — природный полимер. Строение и свойства целлюлозы в сравнении с крахмалом. Нахождение в природе, биологическая роль, получение и применение целлюлозы.
Демонстрации
1.Реакция «серебряного зеркала» на примере глюкозы.
2.Взаимодействие глюкозы с гидроксидом меди(II) при обычных условиях и при нагревании.
3.Отношение сахарозы к гидроксиду меди(II) и при нагревании.
4.Гидролиз сахарозы.
5.Гидролиз целлюлозы и крахмала.
6.Взаимодействие крахмала с иодом.
Лабораторные опыты
№9. Взаимодействие глюкозы с гидроксидом меди (II) и оксидом серебра (I).
№10. Взаимодействие сахарозы с гидроксидом кальция.
№11. Взаимодействие крахмала с иодом, гидролиз крахмала.
№12. Ознакомление с образцами природных и искусственных волокон.
Практическая работа
№5. Решение экспериментальных задач на получение и распознавание органических веществ.
Расчетные задачи
Решение задач на установление химической формулы вещества: а) по известной общей формуле и массовой доле одного из элементов, б) по его реакционной способности.
В результате изучения темы учащиеся должны
Знать
классификацию углеводов, состав, строение молекул глюкозы, рибозы, дезоксирибозы, иметь представление об оптической изомерии;
нахождение в природе, физические и химические свойства глюкозы, ее получение и применение;
состав и строение важнейших дисахаридов, физические и химические свойства, получение и применение сахарозы;
состав и строение крахмала, физические и химические свойства, получение и применение, определение понятия «реакция поликонденсации»;
строение молекул, нахождение в природе, получение, физические и химические свойства, применение целлюлозы, понятие об искусственных волокнах;
Уметь
записывать линейные и циклические формы молекул глюкозы, рибозы и дезоксирибозы.
характеризовать свойства глюкозы как альдегидоспирта;
называть вещества и записывать их структурные формулы, характеризовать физические и химические свойства, получение и применение;
проводить хим. эксперимент, соблюдая правила ТБ;
распознавать органические вещества по их физическим и химическим свойствам; записывать схемы реакций.
Тема 10. Азотсодержащие органические соединения – 8 часов.
Амины. Состав, строение молекул, номенклатура. Строение аминогруппы. Физические и химические свойства. Амины как органические основания: взаимодействие с водой и кислотами. Горение аминов. Получение и применение.
Аминокислоты. Номенклатура, изомерия, получение и физические свойства. Аминокислоты как амфотерные органические соединения. Пептидная связь. Биологическое значение аминокислот (заменимые и незаменимые кислоты). Области применения аминокислот.
Белки как природные полимеры. Состав и строение белков. Физические и химические свойства белков, качественные (цветные) реакции на белки. Превращение белков пищи в организме. Биологические функции белков.
Понятие об азотсодержащих гетероциклических соединениях.
Нуклеиновые кислоты.
Химия и здоровье человека.
Демонстрации
1. Свойства метиламина: горение, взаимодействие с водой и кислотами.
2. Образцы аминокислот.
3.Доказательство наличия функциональных групп в молекулах аминокислот.
4. Растворение белков в воде.
5. Денатурация белков при нагревании, под действием кислот и солей тяжелых металлов.
Лабораторные опыты
№13. Цветные реакции на белки.
Расчетные задачи
Решение задач на установление химической формулы вещества: а) по известной общей формуле и массовой доле одного из элементов, б) по его реакционной способности
В результате изучения темы учащиеся должны
Знать
определение класса «амины», классификацию, номенклатуру, изомерию, физические свойства, способы получения аминов;
химические свойства аминов как органических оснований, качественную реакцию на амины;
определения понятий «аминокислоты», «пептидная связь», «полипептид», «реакция поликонденсации», номенклатуру, изомерию АК; свойства АК как органических амфотерных соединений, получение АК, их значение;
строение и классификацию белков, химические свойства белков (денатурация, гидролиз, качественные реакции, горение), биологическую роль;
определение понятия «гетероциклические соединения», представителей, их структурные формулы, свойства;
понятие о нуклеиновых кислотах, нуклеотидах, пиримидиновых и пуриновых азотистых основаниях, биологическую роль ДНК и РНК;
иметь общее представление о лекарствах как химиотерапевтических препаратах;
отдельные группы лекарств, способы безопасного применения лекарств.
Уметь
записывать структурные формулы представителей аминов, называть их, составлять и находить структурные формулы изомерных аминов, характеризовать физические свойства аминов и записывать схемы реакций получения;
определять характер взаимного влияния атомов в молекуле, характеризовать строение и свойства аминов, записывать схемы реакций с их участием;
называть вещества по тривиальной и международной номенклатуре;
характеризовать строение и свойства органических соединений;
объяснять зависимость свойств веществ от их состава и строения;
характеризовать строение и свойства изученных соединений;
определять принадлежность веществ к различным классам органических соединений; проводить химический эксперимент по распознаванию важнейших органических веществ;
записывать структурные формулы гетероциклических соединений;
характеризовать нуклеиновые кислоты, их биологическую роль;
записывать схемы реакций, характеризующих химические свойства, способы получения, генетическую связь между классами органических соединений.
Тема 11. Синтетические полимеры - 5 часов.
Полимеры, получаемые в реакциях полимеризации (полиэтилен, полипропилен) и в реакциях поликонденсации (фенолформальдегидная смола): строение молекул, получение, физические и химические свойства, применение.
Синтетические каучуки. Строение, получение, важнейщие свойства и применение.
Волокна. Природные (натуральные) волокна. Понятие об искусственных волокнах: ацетатном и вискозном. Синтетические волокна. Полиамидное (капрон) и полиэфирное (лавсан) волокна, их строение, свойства, практическое использование.
Демонстрации
Образцы натуральных, искусственных, синтетических волокон и изделия из них
Лабораторные опыты
1.Изучение свойств термопластичных полимеров.
2.Определение хлора в поливинилхлориде.
3.Изучение свойств синтетических волокон.
Практическая работа
№6. Распознавание пластмасс и волокон.
В результате изучения темы учащиеся должны
Знать
определение понятий «реакция полимеризации», «реакция поликонденсации», «мономер», «полимер», «структурное звено», «степень полимеризации»;
важнейшие полимеры, их строение, получение, физические и химические свойства, применение;
важнейшие синтетические каучуки, их получение, специфические свойства и применение;
классификацию волокон, важнейших представителей, их получение, свойства, применение;
свойства пластмасс и волокон.
Уметь
называть важнейшие полимеры, записывать их структурные формулы, характеризовать получение, физические и химические свойства, применение;
характеризовать важнейшие синтетические каучуки, их получение, специфические свойства и применение;
называть волокна и характеризовать их;
характеризовать значение органической химии для человека и природы;
работать с дополнительными источниками информации, готовить сообщения, доклады, разрабатывать проекты, аргументировать свою точку зрения;
выполнять хим.эксперимент по распознаванию пластмасс и волокон с использованием таблицы распознавания, соблюдая правила ТБ.
Тема 12. Повторение и обобщение знаний по органической химии за 10 класс (3 часа)
Формы и средства контроля
Текущий контроль знаний проводится в форме опросов, экспресс-опросов (для оперативной проверки уровня готовности к восприятию нового материала), самостоятельных работ. Промежуточный контроль за качеством обучения и усвоения материала осуществляется в форме письменных контрольных, самостоятельных, проверочных работ, контрольных работ по текстам администрации общеобразовательного учреждения (с заданиями разного уровня сложности), тестирование. На практических работах применяется наблюдение за формированием умений, навыков и приемов применения практических знаний. Итоговый контроль знаний проводится в форме итогового тестирования.
Проверка и оценка знаний и умений обучающихся
Результаты обучения химии должны соответствовать общим задачам предмета и требованиям к его усвоению.
Результаты обучения оцениваются по пятибалльной системе. При оценке учитываются следующие качественные показатели ответов:
глубина (соответствие изученным теоретическим обобщениям);
осознанность (соответствие требуемым в программе умениям применять полученную информацию);
полнота (соответствие объему программы и информации учебника).
При оценке учитываются число и характер ошибок (существенные или несущественные).
Существенные ошибки связаны с недостаточной глубиной и осознанностью ответа (например, ученик неправильно указал основные признаки понятий, явлений, характерные свойства веществ, неправильно сформулировал закон, правило и т.п. или ученик не смог применить теоретические знания для объяснения и предсказания явлений, установления
причинно-следственных связей, сравнения и классификации явлений и т. п.).
Несущественные ошибки определяются неполнотой ответа (например, упущение из вида какого-либо нехарактерного факта при описании вещества, процесса). К ним можно отнести оговорки, описки, допущенные по невнимательности (например, на два и более уравнения реакций в полном ионном виде допущена одна ошибка в обозначении заряда иона).
Результаты обучения проверяются в процессе устных и письменных ответов учащихся, а также при выполнении ими химического эксперимента.
Оценка теоретических знаний
Отметка «5»:
ответ полный и правильный на основании изученных теорий; материал изложен в определенной логической последовательности, литературным языком; ответ самостоятельный.
Отметка «4»:
ответ полный и правильный на основании изученных теорий; материал изложен в определенной логической последовательности, при этом допущены
две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «3»:
ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:
при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя.
Отметка «1»:
отсутствие ответа.
Оценка экспериментальных умений
Оценка ставится на основании наблюдения за учащимся и письменного отчета за работу.
Отметка «5»:
работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы; эксперимент проведен по плану с учетом техники безопасности и правил работы с веществами и оборудованием; проявлены организационно-трудовые умения (поддерживаются чистота рабочего места и порядок на столе, экономно используются реактивы).
Отметка «4»:
работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
допущены две (и более) существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя.
Отметка «1»:
работа не выполнена, у учащегося отсутствуют экспериментальные умения.
Оценка умений решать экспериментальные задачи
Отметка «5»:
план решения составлен правильно; правильно осуществлен подбор химических реактивов и оборудования; дано полное объяснение и сделаны выводы.
Отметка «4»:
план решения составлен правильно; правильно осуществлен подбор химических реактивов и оборудования, при этом допущено не более двух несущественных ошибок в объяснении и выводах.
Отметка «3»:
план решения составлен правильно; правильно осуществлен подбор химических реактивов и оборудования, но допущена существенная ошибка в объяснении и выводах.
Отметка «2»:
допущены две (и более) существенные ошибки в плане решения, в подборе химических реактивов и оборудования, в объяснении и выводах.
Отметка «1»:
задача не решена.
Оценка умений решать расчетные задачи
Отметка «5»:
в логическом рассуждении и решении нет ошибок, задача решена рациональным способом.
Отметка «4»:
в логическом рассуждении и решении нет существенных ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Отметка «3»:
в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
имеются существенные ошибки в логическом рассуждении и решении.
Отметка «1»:
задача не решена.
Оценка письменных контрольных работ
Отметка «5»:
ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
работа выполнена не менее чем наполовину, допущена одна существенная ошибка и две-три несущественные.
Отметка «2»:
работа выполнена менее чем наполовину или содержит несколько существенных
ошибок.
Отметка «1»:
работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
Отметка за итоговую контрольную работу корректирует предшествующие отметки за четверть, полугодие, год.
Перечень учебно-методических средств обучения.
Учебно-методический комплекс
Рудзитис Г.Е., Фельдман Ф.Г. Химия. Органическая химия. 10 класс: учебник для общеобразовательных учреждений. – М.: Просвещение, 2011
Гара Н.Н. Примерная программа среднего (полного) общего образования по химии (базовый уровень)
Электронное приложение к учебнику Г.Е.Рудзитиса, Ф.Г.Фельдмана.
Литература для учителя
Аргишева А.И., Губанова Ю.К. Решаем задачи по химии. – Саратов: ОАО «Издательство «Лицей», 2002
Доронькин В.Н. и др. Химия. Тематические тесты для подготовки к ЕГЭ. Задания высокого уровня сложности (С1-С5): учебно-методическое пособие. – Ростов-на-Дону: Издательство «Легион», 2011
Доронькин В.Н. и др. Химия. Подготовка к ЕГЭ. Тематические тесты. Базовый и повышенный уровни. 10-11 классы: учебно-методическое пособие. – Ростов-на-Дону: Издательство «Легион», 2011
Кушнарев А.А. Задачи по химии для старшеклассников и абитуриентов. – М.: «Школа-Пресс», 1999
Слета Л.А., Черный А.В., Холин Ю.В. 1001 задача по химии. – Москва-Харьков: «Илекса», «Ранок», 2005
Хомченко И.Г. Сборник задач и упражнений по химии. – М.: Высшая школа, 1989
Ширшина Н.В. Химия. 10-11 классы: индивидуальный контроль знаний. Карточки-задания. – Волгоград: Издательство «Учитель», 2011
Литература для учащихся
Рудзитис Г.Е., Фельдман Ф.Г. Химия: для 8 класса общеобразовательных учреждений. – М.: Просвещение, 2009
Доронькин В.Н. и др. Химия. Тематические тесты для подготовки к ЕГЭ. Задания высокого уровня сложности (С1-С5): учебно-методическое пособие. – Ростов-на-Дону: Издательство «Легион», 2011
Доронькин В.Н. и др. Химия. Подготовка к ЕГЭ. Тематические тесты. Базовый и повышенный уровни. 10-11 классы: учебно-методическое пособие. – Ростов-на-Дону: Издательство «Легион», 2011
MULTIMEDIA – поддержка предмета
Библиотека электронных наглядных пособий. Химия 8-11 классы. – ГУ РЦ ЭМТО «Кирилл и Мефодий», 2003
Интерактивный учебно-методический образовательный комплекс. Химия, 10-11 классы.
Мультимедиа комплекс для средней школы. Органическая химия 10-11 классы. – ЦНИТ СГАУ, 2001
Образовательная коллекция. «Химия для всех-XXI. Решение задач» - ЗАО «1С», 2004
Органическая химия. Мультимедийное сопровождение уроков. – Волгоград: Издательство «Учитель», 2012
CD-ROM «Химия для гуманитариев. Элективный курс» - Волгоград: Издательство «Учитель», 2012
CD-ROM «Химия общая и неорганическая. 10-11 классы». – Лаборатория систем мультимедиа, МарГТУ, 2004
Учебное электронное издание. Химия (8-11 классы). Виртуальная лаборатория. – Лаборатория систем мультимедиа, МарГТУ, 2004
http://files.school-collection.edu.ru
http://festival.1september.ru
Лабораторные работы 10 класс.
№1 Изготовление моделей молекул углеводородов и галогенопроизводных.
№2 Изготовление моделей молекул непредельных углеводородов и галогенопроизводных.
№3 Ознакомление с образцами продуктов нефтепереработки.
№4 Растворение глицерина в воде. Реакции глицерина с гидроксидом меди (II).
№5 Окисление метаналя аммиачным раствором оксида серебра. Окисление метаналя гидроксидом меди (II).
№6 Получение этаналя окислением этанола.
№7 Растворимость жиров. Доказательство их непредельного характера. Омыление жиров.
№8 Сравнение свойств мыла и СМС. Знакомство с образцами моющих средств.
№9 Взаимодействие глюкозы с гидроксидом меди (II) и оксидом серебра.
№10 Взаимодействие сахарозы с гидроксидом кальция.
№11 Взаимодействие крахмала с иодом. Гидролиз крахмала.
№12 Ознакомление с образцами природных и искусственных волокон.
№13 Цветные реакции на белки.
№14 Изучение свойств термопластичных полимеров.
№15 Определение хлора в поливинилхлориде.
№16 Изучение свойств синтетических волокон (капрона).
Практические работы 10 класс.
Качественное определение углерода, водорода, хлора в органических веществах.
Получение этилена и изучение его свойств.
Получение и свойства карбоновых кислот.
Решение экспериментальных задач на распознавание органических веществ.
Решение экспериментальных задач на распознавание органических веществ.
Распознавание пластмасс и волокон.
Минимальные требования к оснащению
для реализации практической части программы
| Тема практической работы
| Лабораторное оборудование
|
| Качественное определение углерода, водорода и хлора в органических веществах. | Штатив, пробирка с пробкой и газоотводной трубкой, пробирка с известковой водой, спиртовка, 1 г оксида меди (II), 0,2 г парафина, безводный сульфат меди (II); Спираль из медной проволочки, спиртовка, пробирка с тетрахлорметаном (или другим органическим веществом, содержащем хлор). |
| Получение этилена и опыты с ним. | Штатив, пробирка с пробкой и газоотводной трубкой, спиртовка, 2-3 мл этилового спирта, 6-9 мл концентрированной серной кислоты, пробирка с бромной водой, пробирка с разбавленным раствором перманганата калия. |
| Получение и свойства карбоновых кислот. | Штатив, спиртовка, пробирка с пробкой с газоотводной трубкой, 2-3 г ацетата натрия, 1,5-2 мл концентрированной серной кислоты, пробирка; 2 пробирки, раствор уксусной кислоты, стружки магния, гранулы цинка; Пробирка, 1-1,5 мл раствора гидроксида натрия, индикатор фенолфталеин, раствор уксусной кислоты; Пробирка, 2 мл уксусной кислоты, 2 мл изоамилового спирта, 1 мл концентрированной серной кислоты, пробка со стеклянной трубкой-холодильником; Пробирка, 2 мл свежеприготовленного раствора с массовой долей нитрата серебра (I) 0,02, разбавленный раствор аммиака, муравьиная кислота, колба. |
| Решение задач на распознавание органических соединений
| 4 пробирки под номерами, пробирки, спиртовка, водный раствор гидроксида натрия, серная кислота (разб.), водные р-ры карбоната натрия, перманганата калия, сульфата меди (II), бромная вода, аммиачный раствор оксида серебра. Органические вещества: глицерин, этанол, раствор фенолята натрия, формалин. |
| Решение экспериментальных задач на получение и распознавание органических веществ. | Пробирки под номерами с растворами органических веществ (глицерина, формальдегида, глюкозы), растворы сульфата меди (II), гидроксида натрия, аммиачный раствор оксида серебра (I);
|
| Распознавание пластмасс и волокон
| Пакетики с образцами фенопласта, целлулоида, полиэтилена, капрона, поливинилхлорида, полистирола, полиметилметакрилата. Вискозное волокно и хлопчатобумажное волокно, шерсть, лавсан, спиртовка, 10%-ный раствор гидроксида натрия, р-ры серной кислоты (ρ=1,84) и азотной кислоты (ρ=1,4). |
|
№ уро ка |
Тема урока |
Стандарты |
Планируе- мая дата |
Фактичес-кая дата |
Приме-чание |
|
1.
2. | Повторение основных вопросов курса неорганической химии – 2 часа.
Периодический закон и периодическая система хим. элементов Д.И. Менделеева, химическая связь. Строение и свойства неорганических веществ и их классификация.
|
|
05.09.13.
09.09.13. |
|
|
|
| I. Теория химического строения органических соединений. Электронная природа химических связей. (4 час.)
|
|
|
|
|
| 1.1. | Формирование органической химии как науки. | Знать определения понятий «органическая химия», «органические вещества», «валентность», «структурная формула». Уметь характеризовать значение и роль органической химии в современном обществе, историю возникновения и развития органической химии. | 12.09.13. |
|
|
| 1.2. | Основные положения теории химического строения органических веществ. | Знать основные положения теории, определения понятий «химическое строение», «валентность», «изомерия», «изомеры». Иметь представление о значении теории химического строения органических веществ. Уметь определять изомеры по структурным формулам, валентность химических элементов, записывать молекулярные и структурные формулы органических веществ. | 16.09.13. |
|
|
| 1.3 | Электронная природа химических связей в органических соединениях. | Знать виды электронных орбиталей, типы взаимодействия между ними: σ-связь, π-связь, сущность понятий: обменный и донорно-акцепторный механизм образования ковалентной связи; типы разрыва ковалентной связи: гомо- и гетеролитический, свободные радикалы. Уметь характеризовать механизм образования и разрыва ковалентной связи. | 19.09.13. |
|
|
| 1.4 | Классификация органических соединений. | Знать классификацию ОВ по строению углеродного скелета и по кратности связей, по функциональным группам, определения понятий «ациклические», «циклические» («карбоциклические»), «алициклические», «ароматические», гетероциклические, предельные УВ, непредельные УВ, функциональная группа (ФГ), виды ФГ. Уметь классифицировать ОВ по данным признакам. | 23.09.13. |
|
|
|
| II.Предельные углеводороды (алканы, или парафины). Циклоалканы (циклопарафины). (7час.) |
|
|
|
|
| 2.1. | Алканы. Гомологический ряд, электронное и пространственное строение, номенклатура, изомерия. Лабораторный опыт 1. Изготовление моделей молекул углеводородов и галогенопроизводных. | Знать определение понятия «алканы», их общую формулу, электронную конфигурацию атома углерода в основном и возбужденном состоянии, строение молекулы метана (sp3-гибридизация, валентный угол, тетраэдр). Уметь находить алканы среди других ОВ на основании общей формулы, характеризовать строение молекулы метана. | 26.09.13. |
|
|
| 2.2. | Физические и химические свойства алканов.
| Знать определение понятий «гомологи», «гомологический ряд», «гомологическая разность», гомологический ряд ПУВ, изомерию (структурная изомерия углеродного скелета), номенклатуру ПУВ. Уметь записывать молекулярные и структурные формулы ПУВ и их изомеров, давать им названия. | 30.09.13. |
|
|
| 2.3. | Нахождение в природе, получение, применение алканов.
| Знать нахождение в природе, получение и применение алканов, физические свойства и основные типы реакций, характерные для алканов. Уметь определять типы реакций, характерных для алканов, записывать схемы реакций. | 03.10.13. |
|
|
| 2.4. | Решение задач на вывод молекулярных формул газообразных углеводородов.
| Знать алгоритм решения задачи на установление химической формулы вещества: а) по известному элементному составу, б) по продуктам его сгорания. Уметь производить расчеты по установлению хим. формулы органического соединения.
| 07.10.13. |
|
|
| 2.5. | Циклоалканы Генетическая связь.
| Знать определение понятия «циклоалканы», их общую формулу, гомологический ряд, изомерию, номенклатуру, нахождение в природе, физ. и хим. Свойства, получение и применение. Уметь записывать молекулярные и структурные формулы циклоалканов и их изомеров, давать им названия, записывать схемы реакций. | 10.10.13. |
|
|
| 2.6. | Урок-упражнение. Решение задач. | Знания и умения по теме: решение задач на установление химической формулы вещества: а) по известной общей формуле и массовой доле одного из элементов, б) по его реакционной способности; записывать структурные формулы и схемы реакций, называть вещества. | 14.10.13. |
|
|
| 2.7. | Практическая работа №1 «Качественное определение углерода, водорода и хлора в органических веществах» | Уметь выполнять химический эксперимент, соблюдая правила ТБ. | 17.10.13. |
|
|
|
| III.Непредельные углеводороды (алкены, алкадиены и алкины). (6 час.)
|
|
|
|
|
| 3.1. | Электронное и пространственное строение алкенов. Гомология и изомерия алкенов. Получение алкенов. Лабораторный опыт 2. Изготовление моделей молекул непредельных углеводородов и галогенопроизводных. | Знать определение «алкены», их общую формулу, строение молекул, номенклатуру, изомерию, способы получения, правило Зайцева. Уметь составлять молекулярные и структурные формулы алкенов и их изомеров и давать им названия, записывать схемы реакций получения. | 21.10.13. |
|
|
| 3.2 | Свойства и применение алкенов. | Знать физические и химические свойства алкенов: реакции присоединения, окисления, полимеризации; определения понятий: реакция гидрирования, гидратации, галогенирования, гидрогалогенирования, полимеризации, мономер, полимер, структурное звено, степень полимеризации; правило Марковникова; качественные реакции на алкены, применение алкенов. Уметь записывать схемы реакций, отражающих хим. свойства алкенов, определять тип реакции. | 24.10.13. |
|
|
| 3.3. | Практическая работа №2 «Получение этилена и опыты с ним». | Уметь выполнять химический эксперимент, соблюдая правила ТБ. | 28.10.13. |
|
|
| 3.4. | Химические свойства алкадиенов. Каучуки. | Знать химические свойства алкадиенов, применение алкадиенов; определение понятия «каучуки» и их представителей. Уметь записывать схемы реакций, отражающих хим. свойства алкадиенов, характеризовать состав и свойства каучуков. | 31.10.13. |
|
|
| 3.5 | Алкины. | Знать определение «алкины», общую формулу, строение молекул, изомерию, номенклатуру, физические свойства, способы получения алкинов. Уметь записывать схемы реакций получения алкинов, определять их тип, записывать структурные формулы изомеров и называть их. | 11.11.13. |
|
|
| 3.6 | Решение расчетных задач. Генетическая связь.
| Знания и умения по теме: решение задач на установление химической формулы вещества: а) по известной общей формуле и массовой доле одного из элементов, б) по его реакционной способности; записывать структурные формулы и схемы реакций, называть вещества. | 14.11.13. |
|
|
|
| IV.Ароматические углеводороды (арены) (6 час.)
|
|
|
|
|
| 4.1 | Бензол и его гомологи. Физические и химические свойства аренов. | Знать определение понятий: ароматические УВ, ароматическая связь; строение молекулы бензола, названия и формулы важнейших гомологов бензола, изомерию, номенклатуру, способы получения. Уметь определять тип хим. реакции, характеризовать строение и свойства вещества. | 18.11.13. |
|
|
| 4.2 | Особенности химических свойств гомологов бензола (на примере толуола).
| Знать физ. и хим. свойства, применение бензола и его гомологов. Уметь определять характер взаимного влияния атомов в молекулах, объяснять зависимость реакционной способности органических соединений от строения их молекул. | 21.11.13. |
|
|
| 4.3 | Получение и применение аренов. | Знать основные понятия темы. Уметь определять принадлежность веществ к определенному классу органических соединений; записывать схемы хим. реакций, лежащих в основе цепочки превращений. | 25.11.13. |
|
|
| 4.4 | Генетическая связь между классами углеводородов. | Знать основные понятия темы. Уметь определять принадлежность веществ к определенному классу органических соединений; записывать схемы хим. реакций, лежащих в основе цепочки превращений. | 28.11.13. |
|
|
| 4.5 | Подготовка к контрольной работе. | Знания и умения по теме. Знать основные понятия и содержание темы. | 02.12.13. |
|
|
| 4.6 | Контрольная работа №1 по теме «Углеводороды» | Знания и умения по теме. | 05.12.13. |
|
|
|
| V.Природные источники углеводородов и их переработка. (3 часа)
|
|
|
|
|
| 5.1 | Природный газ. Попутные нефтяные газы. | Знать природные источники углеводородов, их состав, месторождения, промышленную переработку и продукты переработки. Уметь записывать схемы реакций, решать расчетные задачи. | 09.12.13. |
|
|
| 5.2 | Нефть, нефтепродукты. Перегонка нефти.
Лабораторный опыт 3. Ознакомление с образцами продуктов нефтепереработки (и коксования каменного угля). | Знать природные источники углеводородов, их состав, месторождения, промышленную переработку и продукты переработки. Уметь записывать схемы реакций, решать расчетные задачи. | 12.12.13. |
|
|
| 5.3 | Коксохимическое производство.
| Знать природные источники углеводородов, их состав, месторождения, промышленную переработку и продукты переработки. Уметь записывать схемы реакций, решать расчетные задачи. | 16.12.13. |
|
|
|
| VI.Спирты и фенолы. (6 час.) |
|
|
|
|
| 6.1 | Одноатомные предельные спирты. Строение молекул, изомерия и номенклатура. | Знать определение понятия «спирты», «функциональная группа», общую формулу одноатомных предельных спиртов, строение молекул, изомерию, номенклатуру. Уметь характеризовать образование водородной связи между молекулами и ее влияние на физические свойства спиртов. | 19.12.13. |
|
|
| 6.2 | Химические свойства спиртов.
| Знать физ. и хим. свойства предельных одноатомных спиртов, применение, понятие «водородная связь». Уметь записывать схемы реакций, отражающих хим. свойства и получение предельных одноатомных спиртов. | 23.12.13. |
|
|
| 6.3 | Получение и применение одноатомных предельных спиртов, действие на организм. | Знать способы получения метанола и этанола, физ. и хим. свойства предельных одноатомных спиртов, применение, понятие «водородная связь». Уметь записывать схемы реакций, отражающих хим. свойства и получение предельных одноатомных спиртов. | 26.12.13. |
|
|
| 6.4 | Многоатомные спирты.
Лабораторный опыт 4. Растворение глицерина в воде и реакция его с гидроксидом меди (II). | Знать общую формулу, номенклатуру диолов и триолов; физические и химические свойства, применение этиленгликоля и глицерина; качественную реакцию на многоатомные спирты. Уметь записывать схемы реакций с участием многоатомных спиртов, характеризовать этиленгликоль и глицерин. | 30.12.13. |
|
|
| 6.5 | Фенолы. Свойства фенола и его применение.
| Знать понятия «ароматические спирты», «фенолы», представителей данных классов; строение молекулы фенола, получение. Уметь записывать молекулярные и структурные формулы фенолов и ароматических спиртов и давать им названия. | 13.01.14. |
|
|
| 6.6 | Самостоятельная работа.
|
| 16.01.14. |
|
|
|
| VII.Альдегиды, кетоны и карбоновые кислоты (10 часов) |
|
|
|
|
| 7.1 | Альдегиды, строение, классификация, физические свойства, номенклатура, изомерия. Химические свойства.
Лабораторный опыт 5. Получение этаналя окислением этанола. | Знать определение понятий «альдегиды», «кетоны», общие формулы, важнейших представителей, номенклатуру, изомерию, способы получения. Уметь записывать молекулярные и структурные формулы альдегидов и кетонов, их изомеров, давать названия, записывать схемы реакций получения. | 20.01.14. |
|
|
| 7.2 |
Применение и получение альдегидов. Лабораторный опыт 6. Окисление метаналя (этаналя). | Знать физические и химические свойства альдегидов, качественные реакции на альдегиды, применение. Уметь характеризовать физические и химические свойства альдегидов и кетонов. Записывать схемы реакций. | 23.01.14. |
|
|
| 7.3 | Кетоны, строение, свойства, получение, применение. Генетическая связь.
| Знать физические и химические свойства кетонов, качественные реакции на альдегиды, применение. Уметь характеризовать физические и химические свойства кетонов. Записывать схемы реакций. | 27.01.14. |
|
|
| 7.4 | Классификация карбоновых кислот, строение, номенклатура, изомерия, физические свойства.
| Знать определение понятия «карбоновые кислоты», общую формулу, номенклатуру, классификацию, важнейших представителей, их физические свойства; изомерию, получение предельных одноосновных карбоновых кислот. Уметь записывать структурные формулы карбоновых кислот, называть их, характеризовать физ. свойства; записывать схемы реакций получения предельных одноосновных карбоновых кислот. | 30.01.14. |
|
|
| 7.5 | Химические свойства карбоновых кислот. | Знать химические свойства одноосновных предельных карбоновых кислот. Уметь характеризовать хим. свойства одноосновных предельных карбоновых кислот в свете учения о взаимном влиянии атомов в молекуле; записывать схемы хим. реакций. | 03.02.14. |
|
|
| 7.6 | Получение, применение карбоновых кислот.
| Знать получение одноосновных предельных карбоновых кислот. Уметь характеризовать хим. свойства одноосновных предельных карбоновых кислот в свете учения о взаимном влиянии атомов в молекуле; записывать схемы хим. реакций. | 06.02.14. |
|
|
| 7.7 | Отдельные представители карбоновых кислот, непредельные одноосновные карбоновые кислоты. Генетическая связь. Решение расчетных задач.
| Знать названия, молекулярные и структурные формулы акриловой, метакриловой, стеариновой, олеиновой, линолевой кислот, их физ. и хим. свойства, применение. Уметь записывать структурные формулы непредельных карбоновых кислот, записывать схемы реакций, характеризующих хим. свойства и генетическую связь карбоновых кислот с другими классами органических соединений. | 10.02.14. |
|
|
| 7.8 | Практическая работа №3 «Получение и свойства карбоновых кислот» | Знать хим. свойства альдегидов и карбоновых кислот. Уметь проводить хим. эксперимент, соблюдая правила ТБ, записывать схемы реакций. | 13.02.14. |
|
|
| 7.9 | Практическая работа №4. «Решение экспериментальных задач на распознавание органических веществ». | Знать хим. свойства изученных классов углеводородов и кислородсодержащих органических веществ, качественные реакции. Уметь проводить хим. эксперимент, соблюдая правила ТБ, распознавать органические вещества по их физ. и хим. свойствам, записывать схемы реакций. | 17.02.14. |
|
|
| 7.10 | Контрольная работа №2 по теме: «Альдегиды. Карбоновые кислоты».
|
| 20.02.14. |
|
|
|
| VIII.Сложные эфиры. Жиры. (3часа) |
|
|
|
|
| 8.1 | Сложные эфиры. Строение, свойства, применение. | Знать определение, общую формулу, номенклатуру, изомерию, физ. и хим. свойства, получение, применение. Уметь записывать структурные формулы сложных эфиров, называть их, изображать структурные формулы изомеров, характеризовать физ. и хим. свойства , записывать схемы реакций получения и хим. свойств. | 24.02.14. |
|
|
| 8.2 | Жиры. Строение, свойства, применение.
Лабораторный опыт 7. Растворимость жиров, доказательство их непредельного характера, омыление жиров.
Лабораторный опыт 8. Сравнение свойств мыла и синтетических моющих средств. | Знать определение класса, общую формулу, классификацию, физ. и хим. свойства (гидрирование, гидратация, щелочной гидролиз); свойства мыла и СМС. Уметь характеризовать свойства жиров. | 27.02.14. |
|
|
| 8.3 | Урок-упражнение. Решение задач. | Знания и умения по теме: решение задач на установление химической формулы вещества: а) по известной общей формуле и массовой доле одного из элементов, б) по его реакционной способности; записывать структурные формулы и схемы реакций, называть вещества. | 03.03.14. |
|
|
|
| IX.Углеводы. (7 час.) |
|
|
|
|
| 9.1 | Углеводы. Моносахариды. Глюкоза. Строение молекулы, изомерия, физические свойства, нахождение в природе. Химические свойства глюкозы, применение.
| Знать классификацию углеводов, состав, строение молекул глюкозы, рибозы, дезоксирибозы, иметь представление об оптической изомерии. Уметь записывать линейные и циклические формы молекул глюкозы, рибозы и дезоксирибозы. | 06.03.14. |
|
|
| 9.2 |
Химические свойства глюкозы, применение. Лабораторный опыт 9. Взаимодействие глюкозы с гидроксидом меди (II) и оксидом серебра (I). | Знать нахождение в природе, физ. и хим.свойства глюкозы, ее получение и применение. Уметь характеризовать свойства глюкозы как альдегидоспирта. | 10.03.14. |
|
|
| 9.3 | Дисахариды. Сахароза. Нахождение в природе, свойства получение, применение. Лабораторный опыт 10. Взаимодействие сахарозы с гидроксидом кальция. | Знать состав и строение важнейших дисахаридов, физ. и хим. свойства, получение и применение сахарозы. Уметь называть вещества и записывать их структурные формулы, характеризовать физ. и хим. свойства. | 13.03.14. |
|
|
| 9.4 | Крахмал, строение, свойства, применение. Лабораторный опыт 11. Взаимодействие крахмала с йодом, гидролиз крахмала. | Знать состав и строение крахмала, физ. и хим. свойства, получение и применение, знать определение понятия «реакции поликонденсации». Уметь называть вещества, записывать структурные формулы, характеризовать физ. и хим. свойства, получение и применение. | 17.03.14. |
|
|
| 9.5 | . Целлюлоза, строение , свойства, применение. Ацетатное волокно. Лабораторный опыт 12. Ознакомление с образцами природных и искусственных волокон. | Знать строение молекул, нахождение в природе, получение, физ.и хим.свойства, применение целлюлозы, понятие об искусственных волокнах. Уметь называть вещества, записывать структурные формулы, характеризовать физ. и хим. свойства, получение и применение. | 20.03.14. |
|
|
| 9.6 | Практическая работа №5 «Решение экспериментальных задач на получение и распознавание органических веществ» | Знать хим. свойства изученных классов органических веществ, качественные реакции. Уметь проводить хим. эксперимент, соблюдая правила ТБ, распознавать органические вещества по их физ. и хим. свойствам, записывать схемы реакций. | 31.03.14. |
|
|
| 9.7 | Самостоятельная работа.
|
| 03.04.14. |
|
|
|
| X.Азотсодержащие соединения (8час.) |
|
|
|
|
| 10.1 | Амины. Амины, состав, строение, номенклатура, изомерия, получение.
| Знать определение класса «амины», классификацию, номенклатуру, изомерию, физ. свойства. способы получения аминов. Уметь записывать структурные формулы представителей аминов, называть их, составлять и находить структурные формулы изомерных аминов, характеризовать физ. свойства аминов и записывать схемы реакций получения. | 07.04.14. |
|
|
| 10.2 | Химические свойства аминов. | Знать хим.свойства аминов как органических оснований, качественную реакцию. Уметь определять характер взаимного влияния атомов в молекуле, характеризовать строение и свойства аминов, записывать схемы реакций с их участием. | 10.04.14. |
|
|
| 10.3 | Ароматические амины. Анилин. Строение, свойства, получение.
| Знать хим.свойства анилина как органических оснований, качественную реакцию. Уметь определять характер взаимного влияния атомов в молекуле, характеризовать строение и свойства аминов, записывать схемы реакций с их участием. | 14.04.14. |
|
|
| 10.4 | Аминокислоты. | Знать определения понятий «аминокислоты», «пептидная связь», «полипептид», «реакция поликонденсации», номенклатуру, изомерию АК; свойства АК как органических амфотерных соединений, получение АК, их значение. Уметь называть вещества по тривиальной и международной номенклатуре, характеризовать строение и свойства органических соединений, объяснять зависимость свойств веществ от их состава и строения. | 17.04.14. |
|
|
| 10.5 | Белки - природные полимеры. Состав, строение белков.
Лабораторный опыт 13. Цветные реакции на белки. | Знать строение и классификацию белков, хим. свойства белков (денатурация, гидролиз, качественные реакции, горение); биологическую роль. Уметь характеризовать строение и свойства изученных соединений; определять принадлежность веществ к различным классам органических соединений; проводить хим. эксперимент по распознаванию важнейших органических веществ. | 21.04.14. |
|
|
| 10.6 | Свойства белков. Превращение белков в организме. Химия и здоровье человека.
| Знать строение и классификацию белков, хим. свойства белков (денатурация, гидролиз, качественные реакции, горение); биологическую роль. Уметь характеризовать строение и свойства изученных соединений; определять принадлежность веществ к различным классам органических соединений; проводить хим. эксперимент по распознаванию важнейших органических веществ. | 24.04.14. |
|
|
| 10.7 | Решение расчетных задач. Генетическая связь.
| Знать определение понятия , представителей, их структурные формулы, свойства. Уметь записывать структурные формулы гетероциклических соединений. | 28.04.14. |
|
|
| 10.8 | Самостоятельная работа. |
| 05.05.14. |
|
|
|
| XI.Синтетические полимеры. (5 час.) |
|
|
|
|
| 11.1 | Общие понятия о ВМС. Реакции полимеризации, поликонденсации. Лабораторный опыт 14. Изучение свойств термопластичных полимеров. Лабораторный опыт 15. Определение хлора в поливинилхлориде. | Знать определение понятий «реакция полимеризации», «реакция поликонденсации», «мономер», «полимер», «структурное звено», «степень полимеризации», важнейшие полимеры, их строение, получение, физ. и хим. свойства, применение. Уметь называть важнейшие полимеры, записывать их структурные формулы, характеризовать получение, физ. и хим. свойства, применение. | 08.05.14. |
|
|
| 11.2 | Классификация пластмасс. | Знать определение понятий «реакция полимеризации», «реакция поликонденсации», «мономер», «полимер», «структурное звено», «степень полимеризации», важнейшие полимеры, их строение, получение, физ. и хим. свойства, применение. Уметь называть важнейшие полимеры, записывать их структурные формулы, характеризовать получение, физ. и хим. свойства, применение. | 12.05.14. |
|
|
| 11.3 | Синтетические каучуки. | Знать важнейшие синтетические каучуки, их получение, специфические свойства и применение. Уметь характеризовать важнейшие синтетические каучуки, их получение, специфические свойства и применение. | 15.05.14. |
|
|
| 11.4 | Синтетические волокна. Лабораторный опыт 16. Изучение свойств синтетических волокон. | Знать классификацию волокон, важнейших представителей, их получение, свойства, применение. Уметь называть волокна и характеризовать их. | 19.05.14. |
|
|
| 11.5 | Практическая работа №6 «Распознавание пластмасс и волокон» | Знать свойства пластмасс и волокон. Уметь выполнять хим.эксперимент по распознаванию пластмасс и волокон с использованием таблицы распознавания, соблюдая правила ТБ. | 22.05.14. |
|
|
|
| Повторение и обобщение знаний по органической химии за 10 класс (3 час.) |
|
|
|
|
|
| Повторение изученного. Подготовка к итоговой контрольной работе. |
| 26.05.14. |
|
|
|
| Итоговая контрольная работа. |
| 29.05.14. |
|
|
|
| Итоговое занятие. Анализ итоговой контрольной работы. |
|
|
|
|
 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая программа по химии (10 класс) (0.1 MB)
Рабочая программа по химии (10 класс) (0.1 MB)
 0
0 484
484 2
2 Нравится
0
Нравится
0


